题目内容
14.下列说法中正确的是( )| A. | 1 mol CO2和1 mol CO所占的体积相同,所含分子数相同 | |
| B. | 1 g CO和1 g CO2所占的体积不同,所含分子数不同 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 某物质若含阿伏加德罗常数个微粒,该物质标准状况下体积约为22.4 L |
分析 A、状况不知,无法求体积的大小;
B、状况不知,无法比较体积的大小;
C、64 g SO2的物质的量为1mol,而二氧化硫与二氧化碳都是三原子分子;
D、状态不知;
解答 解:A、状况不知,无法求体积的大小,所以1 mol CO2和1 mol CO所占的体积在相同条件下相同,所含分子数相同,故A错误;
B、状况不知,无法比较体积的大小,所以1 g CO和1 g CO2在相同条件下所占的体积不同,所含分子数不同,故B错误;
C、64 g SO2的物质的量为1mol,而二氧化硫与二氧化碳都是三原子分子,所以1 mol CO2和64 g SO2所含有分子数和原子总数都相同,故C正确;
D、某气态物质若含阿伏加德罗常数个微粒,该物质标准状况下体积约为22.4 L,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握温度、压强、体积的关系为解答的关键,侧重分析与应用能力的考查,注意气体体积的影响因素,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
2.氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解.
(1)已知:
①H2O的电子式是 .
.
②H2O(g)分解的热化学方程式是2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol.
③11.2L(标准状况)的H2完全燃烧,生成气态水,放出120.5kJ的热量.
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响.常温下,按照如表所示的方案完成实验.
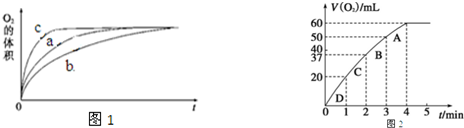
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示.由该图能够得出的实验结论是
其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率.
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示.解释反应速率变化的原因
随着反应的进行,H2O2的浓度逐渐减小,H2O2的分解速率逐渐减慢;计算H2O2的初始物质的量浓度为0.11 mol•L-1 (保留两位有效数字).
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.②H2O(g)分解的热化学方程式是2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol.
③11.2L(标准状况)的H2完全燃烧,生成气态水,放出120.5kJ的热量.
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响.常温下,按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
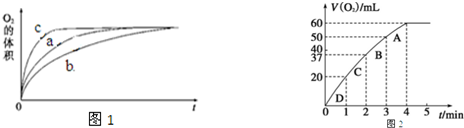
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示.由该图能够得出的实验结论是
其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率.
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示.解释反应速率变化的原因
随着反应的进行,H2O2的浓度逐渐减小,H2O2的分解速率逐渐减慢;计算H2O2的初始物质的量浓度为0.11 mol•L-1 (保留两位有效数字).
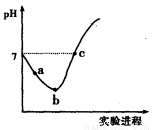
19.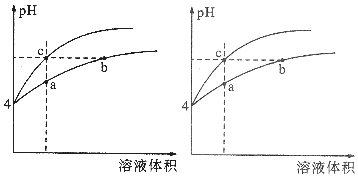 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
3.已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是( )
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1 NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,向二者的饱和溶液中分别加水,平衡均向沉淀溶解方向移动,c(Mg2+)均增大 |
4.下列化合物中属于离子化合物的是( )
| A. | NaOH | B. | NH3 | C. | AlCl3 | D. | HCl |
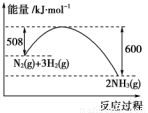
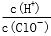 减小
减小
 .
.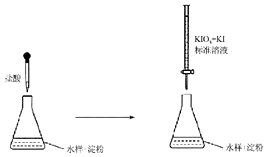 含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.