题目内容
2.氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解.(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.②H2O(g)分解的热化学方程式是2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol.
③11.2L(标准状况)的H2完全燃烧,生成气态水,放出120.5kJ的热量.
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响.常温下,按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
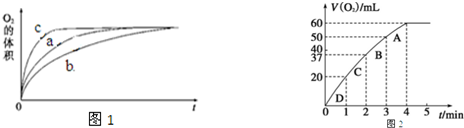
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示.由该图能够得出的实验结论是
其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率.
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示.解释反应速率变化的原因
随着反应的进行,H2O2的浓度逐渐减小,H2O2的分解速率逐渐减慢;计算H2O2的初始物质的量浓度为0.11 mol•L-1 (保留两位有效数字).
分析 (1)①水为共价化合物,水中O原子核外为8个电子;
②水分解生成氧气和氢气,根据共价键断裂吸收能量,形成化学键放出能力,结合方程式计算反应热;
③11.2L(标准状况)的H2为0.5mol,可生成0.5mol水,以此解答;
(2)①溶液的酸碱性不同,反应的速率不同;
②由图象可知,曲线斜率逐渐减小,说明反应速率逐渐减小,结合浓度对反应速率的影响解答该题;根据方程式计算过氧化氢浓度.
解答 解:(1)①H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,
,
故答案为: ;
;
②水分解生成氧气和氢气,方程式为2H2O=2H2+O2,可知2molH2O(g)分解,生成2mol氢气和1mol氧气,则断裂4molO-H,形成1molO=O键、2mol H-H键,
所以吸收的热量为4mol×463kJ/mol=1852kJ,
放出的热量为498kJ+2×436kJ=1370kJ,
所以吸收的热量为1852kJ-1370kJ=482kJ,
所以热化学方程式为2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol,
故答案为:2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol;
③11.2L(标准状况)的H2为0.5mol,可生成0.5mol水,生成气态水放出的热量为0.5mol×$\frac{1}{2}$×482KJ=120.5kJ,
故答案为:120.5;
(2)①abc溶液的酸碱性不同,反应的速率不同,由图象可知在碱性条件下反应速率最大,在酸性条件下反应速率最小,可以得出的结论是其它条件不变,碱性环境能加快H2O2的分解速率,酸性环境能减缓H2O2的分解速率,
故答案为:其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率;
②由图象可知,曲线斜率逐渐减小,说明反应速率逐渐减小,原因是反应物的浓度逐渐减小的原因,
由反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=$\frac{2mol×0.06L}{22.4L}$=0.00536mol,所以c(H2O2)=$\frac{0.00536mol}{0.05L}$=0.11 mol•L-1,
故答案为:随着反应的进行,H2O2的浓度逐渐减小,H2O2的分解速率逐渐减慢;0.11 mol•L-1.
点评 本题考查较为综合,涉及化学反应与能量变化,热化学方程式的书写、反应热的计算,化学反应速率的探究等知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意相关基础知识的积累,难度中等.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 1 mol CO2和1 mol CO所占的体积相同,所含分子数相同 | |
| B. | 1 g CO和1 g CO2所占的体积不同,所含分子数不同 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 某物质若含阿伏加德罗常数个微粒,该物质标准状况下体积约为22.4 L |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 颜色变浅 | B. | 逐渐变红色 | C. | 没有改变 | D. | 变棕黄色 |
 2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是 HSO3-+OH-水解平衡事实的是
HSO3-+OH-水解平衡事实的是