题目内容
9.元素周期表中有①~⑤种元素,用元素符号或化学式填空.
(1)③元素处于周期表中第三周期IIA族.
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是HClO4(填化学式).
(3)写出④的氧化物和氢氧化钠溶液反应的离子方程式:Al2O3+2OH-=H2O+2AlO2-.
(4)用电子式表示③和⑤形成化合物的过程:
 .
.(5)元素⑤的单质与氢氧化钠反应的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
分析 由元素在周期表的位置可知,①~⑤分别为O、Na、Mg、Al、Cl,
(1)Mg的原子结构有3个电子层、最外层电子数为2;
(2)最高价氧化物对应的水化物中高氯酸的酸性最强;
(3)氧化铝与NaOH反应生成偏铝酸钠和水;
(4)③和⑤形成化合物为MgCl2,为离子化合物;
(5)氯气与氢氧化钠反应生成NaCl、NaClO和H2O.
解答 解:由元素在周期表的位置可知,①~⑤分别为O、Na、Mg、Al、Cl,
(1)Mg的原子结构有3个电子层、最外层电子数为2,则③元素处于周期表中第三周期IIA族,故答案为:第三;IIA;
(2)最高价氧化物对应的水化物中高氯酸的酸性最强,其化学式为HClO4,故答案为:HClO4;
(3)氧化铝与NaOH反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=H2O+2AlO2-,故答案为:Al2O3+2OH-=H2O+2AlO2-;
(4)③和⑤形成化合物为MgCl2,为离子化合物,用电子式表示形成过程为 ,
,
故答案为: ;
;
(5)氯气与氢氧化钠反应生成NaCl、NaClO和H2O,化学反应为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
14.下列说法中正确的是( )
| A. | 1 mol CO2和1 mol CO所占的体积相同,所含分子数相同 | |
| B. | 1 g CO和1 g CO2所占的体积不同,所含分子数不同 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 某物质若含阿伏加德罗常数个微粒,该物质标准状况下体积约为22.4 L |
1.把4mol A气体和4mol B气体混合放入2L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)?C(g)+2D(g);经5min达到平衡,测得压强减小了10%,下列说法中正确的是( )
| A. | 平衡体系中C的体积分数为$\frac{1}{9}$ | B. | 平衡时A的浓度为2.4mol/L | ||
| C. | D的平均速率为0.32mol/L•min | D. | B的转化率为20% |
18.A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式3s23p1,E2+价电子的轨道表示式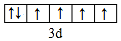 .
.
(2)这5种元素中电负性最大的元素是O(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为N>O>C(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式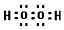 .
.
| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 基态原子中的未成对电子数是同周期中最多的 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
(1)写出D元素基态原子的价电子排布式3s23p1,E2+价电子的轨道表示式
 .
.(2)这5种元素中电负性最大的元素是O(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为N>O>C(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式
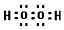 .
.
19.烯烃、炔烃因含不饱和键能被酸性KMnO4溶液氧化,下列各物质中不属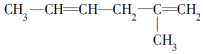 被酸性高锰酸钾氧化的产物的是( )
被酸性高锰酸钾氧化的产物的是( )
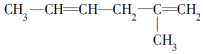 被酸性高锰酸钾氧化的产物的是( )
被酸性高锰酸钾氧化的产物的是( )| A. | CO2 | B. | CH3COOH | ||
| C. | 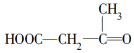 | D. | HOOC-CH2-CH2-COOH |
 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图: