题目内容
6.在托盘天平两边各放一质量同样大小的烧杯,分别加入等体积等浓度的含m mol溶质的稀H2SO4,调节天平平衡后,再向左盘加入a克铁屑,向右盘加入b克铝屑,使之反应,当天平再次平衡时,试讨论在下列情况下,a与b的关系式.当金属都不足时,即金属完全反应,9a=28b.
当金属都过量时,即酸完全反应,a=b.
分析 根据金属与酸反应的化学方程式进行计算,可以从金属都不足与过量的角度进行分析.
解答 解:金属都不足时,则金属完全反应,
Fe+H2SO4=FeSO4+H2↑,△m=2g
56 2
a $\frac{2a}{56}$
2Al+3H2SO4=Al2(SO4)3+3H2↑,△m=6g
54 6
b $\frac{6b}{54}$
则$\frac{2a}{56}=\frac{6b}{54}$,即9a=28b; 9a=28b
故答案为:金属完全反应;9a=28b
当金属都过量时,则酸完全反应,
Fe+H2SO4=FeSO4+H2↑,△m=2g
1 1 2
m m 2m
2Al+3H2SO4=Al2(SO4)3+3H2↑,△m=6g
3 6
m 2m,所以溶液减少的质量均为2m,故只有a=b时,天平才能平衡,
故答案为:酸完全反应;a=b.
点评 本题考查了金属与酸反应生成氢气质量的关系,完成此题目,可依据化学方程式,从酸的质量和金属的质量两个角度进行分析.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | B和C一定都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C不可能都是气体 |
| A. | 常温下,反应 C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 合成氨反应 N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快化学反应速率并提高转化率 | |
| C. | 甲烷和乙醇的燃烧热分别是 891.0 kJ/mol、1366.8 kJ/mol,利用甲烷更“低碳” | |
| D. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转化率高 |
 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点 | |
| C. | 在t℃时,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀 |
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.
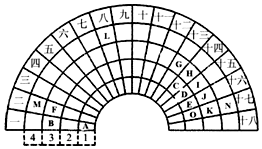 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: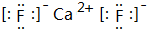 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: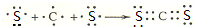 .
.