题目内容
4.T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.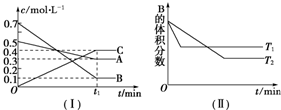
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g),正反应为放热(填“吸热”或“放热”)反应.
(2)在密闭容器中,加入2mol A和6mol B.
①当反应达到平衡时,A和B的浓度比是1:3;A和B的转化率之比是7:15.
②升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变小.(填“变大”、“变小”或“不变”)
③当达到平衡时,充入氩气,并保持压强不变,平衡将逆向(填“正向”、“逆向”或“不”)移动.
分析 (1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比判断反应的化学方程式;由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明生成温度平衡向逆反应方向移动,据此判断该反应是吸热还是放热反应;
(2)①根据三步法计算;
②该反应为放热反应,升高温度,平衡逆向移动,气体的质量不变,物质的量变大,故平均相对分子质量变小;
③压强不变,充入氩气,体积变大,分压减小,平衡向气体体积增大的方向移动,即向逆向移动.
解答 解:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为:A(g)+3B(g)?2C(g);由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明升高温度平衡向逆反应方向移动,正反应为放热反应,
故答案为:A(g)+3B(g)?2C(g);放热;
(2)①根据三步法计算,
A(g)+3B(g)?2C(g)
起始mol/L 0.5 0.7 0
变化mol/L 0.2 0.6 0.4
平衡mol/L 0.3 0.1 0.4
当反应达到平衡时,A和B的浓度比是3:1;A的转化率=$\frac{0.2}{0.5}×100%$,B的转化率=$\frac{0.6}{0.7}×100%$,A和B的转化率之比是7:15,故答案为:7:15;
②该反应为放热反应,升高温度,平衡逆向移动,气体的质量不变,物质的量变大,故平均相对分子质量变小,故答案为:变小;
③压强不变,充入氩气,体积变大,分压减小,平衡向气体体积增大的方向移动,即向逆向移动,故答案为:逆向.
点评 本题考查化学平衡图象问题,题目难度中等,解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键.

| A. | 浓硫酸可刻蚀石英制艺术品 | |
| B. | 活性炭、SO2和Na2O2都具有漂白作用,且漂白的化学原理相同 | |
| C. | 石油的裂化、煤的气化、Na2FeO4杀菌消毒均属于化学变化 | |
| D. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 |
| A. | SO2和NxOy都属于酸性氧化物 | |
| B. | 雾属于胶体,能产生丁达尔效应 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)N和O中,原子半径较小的是O;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是
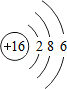 ;
;(5)HF和HCl中,热稳定性较强的是HF;
(6)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)元素最高价氧化物对应的水化物中,具有两性的是Al2O3(填化学式),碱性最强的是NaOH(填化学式);
(8)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2、sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶
胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
 在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.
在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.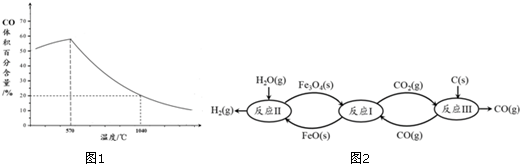

 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图: 为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
 ,由C→B反应类型为加成反应.
,由C→B反应类型为加成反应. 和
和 (写结构简式)两种互为同分异构体杂质生成.
(写结构简式)两种互为同分异构体杂质生成. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;
+NaCl; .
.