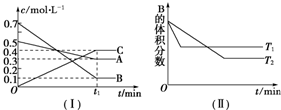
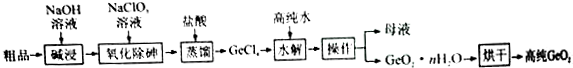
题目内容
13.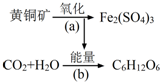 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:(1)写出过程(a)的化学反应方程式:4FeS2+15O2+2H2O$\frac{\underline{\;细菌\;}}{\;}$2Fe2(SO4)3+2H2SO4.
(2)人们还可利用特定的细菌,用Fe2(SO4)3溶液作氧化剂溶解铜矿石(Cu2S),得到透明的酸性溶液,再向溶液中加入足量铁屑得到铜,请写出整个过程中的离子反应方程式:
①Cu2S+10Fe3++4H2O=2Cu2++10Fe2++8H++SO42-②Fe+Cu2+=Fe2++Cu ③Fe+2H+=Fe2++H2↑
(3)下列不属于“细菌冶金”的优点的是C(填写字母).
A、对贫矿、尾矿的开采更有价值
B、在细菌的作用下,副产物FeSO4和S可再次被空气氧化为Fe2(SO4)3和H2SO4,Fe2(SO4)3可循环使用
C、所用细菌来源广泛,很容易找到并大规模培养
D、能大大降低能源消耗,有利于减少污染
(4)工业上可利用粗铜(含Zn、Ag、Au等)经电解制得纯铜(电解铜).电解过程中,粗铜接电源正极(填“正”或“负”),纯铜上的电极反应式为Cu2++2e-=Cu.
(5)某工厂按上述(4)原理,平均每秒生产b mol纯铜,(设阿伏加德罗常数为N,每个电子带电量为e C)求电解槽中平均电流强度为2bNeA(用代数式表示).
分析 (1)在细菌作用下,硫化亚铁被氧气氧化生成硫酸铁和硫酸;
(2)硫化亚铜和铁离子在细菌作用下发生氧化还原反应生成亚铁离子、铜离子、氢离子和硫酸根离子;铁还原铜离子生成铜和亚铁离子;铁和氢离子反应生成亚铁离子和氢气;
(3)A、细菌冶金对贫矿、尾矿的开采很有价值;
B、在细菌的作用下,副产物FeSO4和S都具有还原性,能被空气中氧气氧化;
C、细菌冶炼使用的是具有特殊功能的细菌;
D、细菌冶炼能降低能源,且反应中对环境污染较小;
(4)粗铜冶炼时,粗铜作阳极、纯铜作阴极;
(5)某工厂按上述(4)原理,平均每秒生产b mol纯铜,则平均每秒转移电子物质的量为2bmol,转移电子个数为2bN,每个电子的电量是e,每秒通过电子电量Q=2bNe,电流强度I=$\frac{Q}{t}$.
解答 解:(1)在细菌作用下,硫化亚铁被氧气氧化生成硫酸铁和硫酸,反应方程式为4FeS2+15O2+2H2O$\frac{\underline{\;细菌\;}}{\;}$2Fe2(SO4)3+2H2SO4,
故答案为:4FeS2+15O2+2H2O$\frac{\underline{\;细菌\;}}{\;}$2Fe2(SO4)3+2H2SO4;
(2)硫化亚铜和铁离子在细菌作用下发生氧化还原反应生成亚铁离子、铜离子、氢离子和硫酸根离子;铁还原铜离子生成铜和亚铁离子;铁和氢离子反应生成亚铁离子和氢气,涉及的离子方程式为Cu2S+10Fe3++4H2O=2Cu2++10Fe2++8H++SO42-、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,
故答案为:Cu2S+10Fe3++4H2O=2Cu2++10Fe2++8H++SO42-、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑;
(3)A、细菌冶金不需要富集矿物,所以对贫矿、尾矿的开采很有价值,故A正确;
B、在细菌的作用下,副产物FeSO4和S都具有还原性,易被空气中氧气氧化为Fe2(SO4)3和H2SO4,且Fe2(SO4)3可循环使用,故B正确;
C、细菌冶炼使用的是具有特殊功能的细菌,并不是所有的细菌都有该功能,故C错误;
D、细菌冶炼能降低能源,且反应中对环境污染较小,所以能大大降低能源消耗,有利于减少污染,故D正确;
故答案为:C;
(4)粗铜冶炼时,粗铜作阳极、纯铜作阴极,所以粗铜连接电源正极,阴极反应式为Cu2++2e-=Cu,
故答案为:正;Cu2++2e-=Cu;
(5)某工厂按上述(4)原理,平均每秒生产b mol纯铜,则平均每秒转移电子物质的量为2bmol,转移电子个数为2bN,每个电子的电量是e,每秒通过电子电量Q=2bNe,电流强度I=$\frac{Q}{t}$=$\frac{2bNe}{1}$A=2bNeA,
故答案为:2bNe.
点评 本题以金属冶炼为载体考查氧化还原反应、离子方程式的书写等知识点,为高频考点,明确物质性质及电解原理是解本题关键,难点是电流强度的计算.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案| A. | 核外有38个电子,核内有95个质子 | B. | 核外有38个电子,核内有57个中子 | ||
| C. | 核外有57个电子,核内有57个质子 | D. | 核外有57个电子,核内有38个质子 |
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
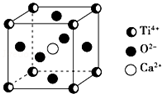 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为236 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
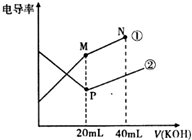
| A. | 曲线②代表0.1mol/L KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在相同温度下,P点水电离程度大于M点 | |
| C. | 在M点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L | |
| D. | 在N点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 做银镜反应实验用的试管在实验前用热碱液洗涤 | |
| B. | 溴乙烷中少量的乙醇不能用水洗分液的方法除去 | |
| C. | 蒸馏石油时,冷凝管中的冷水应上进下出 | |
| D. | 准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤玻璃球,放溶液至21.00mL处 |