题目内容
13.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,22.4 L NH3中含有共价键的数目为3NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数目为0.5NA | |
| D. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA |
分析 A、常温下,气体摩尔体积大于22.4L/mol;
B、铜只能与浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全;
C、标况下四氯化碳为液态;
D、二氧化碳和氧气中均含2个氧原子.
解答 解:A、常温下,气体摩尔体积大于22.4L/mol,故22.4L氨气的物质的量小于1mol,则含有的共价键小于3NA个,故A错误;
B、铜只能与浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、二氧化碳和氧气中均含2个氧原子,故NA个二氧化碳和氧气分子中含有的氧原子的个数为2NA个,与两者的比例无关,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.元素X最高价态的氧化物的水化物为H3XO4,则X的氢化物的化学式是( )
| A. | XH3 | B. | H2X | C. | XH3 | D. | XH4 |
4.下列离子方程式正确的是( )
| A. | 铝溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
1.下列方法可以加快锌和稀硫酸反应生成氢气的反应速率的是( )
| A. | 改用98%的浓硫酸 | B. | 降温 | C. | 加入CuSO4固体 | D. | 加水 |
8.下列有关同分异构体数目的叙述中,正确的是( )
| A. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | 结构简式为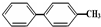 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 |
18.下列性质中不属于烷烃具有性质的是( )
| A. | 燃烧产物只有CO2和H2O | B. | 与溴水发生取代反应 | ||
| C. | 都难溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
5.将0.96g铜投入到一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体.将盛有此气体的容器倒扣在水中.通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是( )
| A. | 540 mL | B. | 336 mL | C. | 224 mL | D. | 168 mL |
2.mg甲烷燃烧后得到CO、CO2和H2O(g)组成的混合气体,其质量为14.4克.将其通过足量碱石灰后,气体质量变为2.8克.则混合气体中H2O的质量是多少( )
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
17.有关电解质的说法正确的是( )
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |