题目内容
17.已知氮原子的质量数为14,则在NH3D1中,电子数、质子数、中子数之比为( )| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
分析 N的质量数为14,质子数为7,中子数为7,H的质量数为1,中子数为0,D的质量数为2,中子数为1,阳离子中电子数=质子数-电荷数,据此分析.
解答 解:N的质量数为14,质子数为7,中子数为14-7=7,
H的质量数为1,中子数为1-1=0,
D的质量数为2,中子数为2-1=1,
阳离子中电子数=质子数-电荷数,
则在微粒NH3D1中,电子数为7+1×3+1-1=10,质子数为7+1×3+1=11,中子数为7+0×3+1=8,则电子数、质子数、中子数之比为10:11:8,
故选D.
点评 本题考查原子的结构知识,侧重于学生的分析能力的考查,注意把握质量数与质子数、中子数的关系,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列有关同分异构体数目的叙述中,正确的是( )
| A. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | 结构简式为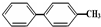 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 |
5.将0.96g铜投入到一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体.将盛有此气体的容器倒扣在水中.通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是( )
| A. | 540 mL | B. | 336 mL | C. | 224 mL | D. | 168 mL |
2.mg甲烷燃烧后得到CO、CO2和H2O(g)组成的混合气体,其质量为14.4克.将其通过足量碱石灰后,气体质量变为2.8克.则混合气体中H2O的质量是多少( )
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
3. 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)关于催化剂在化学反应中的作用,下列叙述正确的是AD(填字母).
A.使反应活化能降低 B.使反应焓变减小 C.使平衡常数增大 D.使反应速率加快
(2)实验①和②的目的是探究反应物浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是:向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
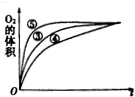
(3)实验③④⑤中,测得生成O2的体积随时间变化关系如图.分析该图可得出的结论是:碱性环境可加快反应速率;酸性环境可减慢反应速率.
 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分 组 实 验 | 催化剂 | |
| ① | 10mL 5%的H2O2溶液 | 无 |
| ② | 10mL 2%的H2O2溶液 | 无 |
| ③ | 10mL 5%的H2O2溶液 | 1mL 0.1mol/L的FeCl3溶液 |
| ④ | 10mL 5%的H2O2溶液+少量盐酸 | 1mL 0.1mol/L的FeCl3溶液 |
| ⑤ | 10mL 5%的H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/L的FeCl3溶液 |
A.使反应活化能降低 B.使反应焓变减小 C.使平衡常数增大 D.使反应速率加快
(2)实验①和②的目的是探究反应物浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是:向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③④⑤中,测得生成O2的体积随时间变化关系如图.分析该图可得出的结论是:碱性环境可加快反应速率;酸性环境可减慢反应速率.
20.某化学兴趣小组利用如图装罝进行某些物质的制备和性质实验(图中部分夹持装置省略).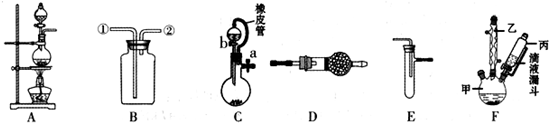
(1)为制取干燥氨气,可将装置C与D连接,C中橡皮管的作用是平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;装置D中的固体宜选用碱石灰.
(2)利用装罝A和E组合实验可比较Cl2和I2的氧化性强弱.若E中盛有混合液体,下层是CCl4,充分反应后,振荡E,观察到能证明Cl2和I2氧化性强弱的实验现象是四氯化碳层由无色变为紫红色,其反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)在装罝B中装满水可用来收集NO,此时NO气体的入口是②(填①或②).
(4)利用装罝F可在实验室中制备对氯苯甲酸( ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
实验步骤:在装置F250mL的三颈烧瓶中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯(6.42g),在温度约93℃时,逐滴滴入对氯甲苯,并控制温度在93℃左右,反应2小时,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,并加入稀硫酸酸化、加热浓缩,再过滤,将滤渣用冷水洗涤,干燥后称量滤渣质量为7.19g.清回答下列问题:
①量取6.OOmL对氯甲苯应选用的仪器是C(填正确选项的编号).
A.10mL量筒 B.50mL容量瓶 C.25mL酸式滴定管 D.25mL碱式滴定管
②控制温度在93℃左右的加热方法是水浴加热.
③将洗涤液与滤液合并后加入稀硫酸酸化时,可观察到的实验现象是产生白色沉淀.
④本实验的产率约为D(填正确选项的编号).
A.60% B.70% C.80% D.90%

(1)为制取干燥氨气,可将装置C与D连接,C中橡皮管的作用是平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;装置D中的固体宜选用碱石灰.
(2)利用装罝A和E组合实验可比较Cl2和I2的氧化性强弱.若E中盛有混合液体,下层是CCl4,充分反应后,振荡E,观察到能证明Cl2和I2氧化性强弱的实验现象是四氯化碳层由无色变为紫红色,其反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)在装罝B中装满水可用来收集NO,此时NO气体的入口是②(填①或②).
(4)利用装罝F可在实验室中制备对氯苯甲酸(
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
①量取6.OOmL对氯甲苯应选用的仪器是C(填正确选项的编号).
A.10mL量筒 B.50mL容量瓶 C.25mL酸式滴定管 D.25mL碱式滴定管
②控制温度在93℃左右的加热方法是水浴加热.
③将洗涤液与滤液合并后加入稀硫酸酸化时,可观察到的实验现象是产生白色沉淀.
④本实验的产率约为D(填正确选项的编号).
A.60% B.70% C.80% D.90%
1.把下列四种X溶液分别加入四个盛有10ml 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |