题目内容
下列说法正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、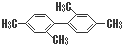 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol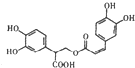 有机物 一定条件下能和7molNaOH反应 有机物 一定条件下能和7molNaOH反应 |
考点:乙烯的化学性质,有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:A.聚乙烯不含有C=C,不与高锰酸钾反应;
B、酸能与碳酸氢钠反应生成二氧化碳;
C、依据甲烷与苯的结构分析即可;
D、酚羟基、酯基、羧基均能与氢氧化钠反应.
B、酸能与碳酸氢钠反应生成二氧化碳;
C、依据甲烷与苯的结构分析即可;
D、酚羟基、酯基、羧基均能与氢氧化钠反应.
解答:
解:A.乙烯、氯乙烯含有C=C,能使高锰酸钾溶液褪色,聚乙烯不含有C=C,不与高锰酸钾溶液反应,故A错误;
B、分子式为C4H7ClO2,其属于酸的同分异构体有两种,因为丁烷的同分异构体只有两种(正丁烷、异丁烷),且羧基必须位于链端,故可与NaHCO3产生CO2的有机物可能结构有3种,故B错误;
C、甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面,两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面.如图所示(已编号)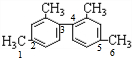 的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故C正确;
的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故C正确;
D、1mol 中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基1mol,能消耗氢氧化钠1mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol
中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基1mol,能消耗氢氧化钠1mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol 最多可与6molNaOH,故D错误,故选C.
最多可与6molNaOH,故D错误,故选C.
B、分子式为C4H7ClO2,其属于酸的同分异构体有两种,因为丁烷的同分异构体只有两种(正丁烷、异丁烷),且羧基必须位于链端,故可与NaHCO3产生CO2的有机物可能结构有3种,故B错误;
C、甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面,两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面.如图所示(已编号)
 的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故C正确;
的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故C正确;D、1mol
 中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基1mol,能消耗氢氧化钠1mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol
中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基1mol,能消耗氢氧化钠1mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol 最多可与6molNaOH,故D错误,故选C.
最多可与6molNaOH,故D错误,故选C.
点评:本题考查学生有关官能团决定性质的知识,要要求学生熟记官能团具有的性质,并熟练运用.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
反应A(g)+3B(g)?2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
| A、v(A)=0.15 mol/(L?min) |
| B、v(B)=0.06 mol/(L?min) |
| C、v(C)=0.04 mol/(L?s) |
| D、v(D)=0.01 mol/(L?s)) |
下列能说明可逆反应2A(g)+B(g)?2C(g)+D(g)在一定条件下已达到化学平衡状态的事实是( )
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、C的生成速率是D的生成速率的两倍 |
| D、A的消耗速率是D的消耗速率的两倍 |
往一体积不变的密闭容器中充入H2和I2,发生反应H2 (g)+I2 (g)?2HI(g)△H<0,当达到平衡后,t0时刻改变某一条件(混合气体量不变),容器内压强增大,下列说法正确的是( )
| A、可能为升温 |
| B、平衡一定不移动 |
| C、H2 转化率增大 |
| D、HI平衡浓度一定变大 |
下列措施或事实不能用勒夏特列原理解释的是( )
| A、新制的氯水在光照下颜色变浅 |
| B、合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| C、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| D、实验室中常用排饱和食盐水的方式收集氯气 |
一个原电池的总反应的离子方程式是Zn+Cu2+═Zn2++Cu,该原电池的合理组成是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | CuSO4 |
| B | Cu | Zn | H2SO4 |
| C | Zn | Cu | CuCl2 |
| D | Mg | Zn | CuCl2 |
| A、A | B、B | C、C | D、D |
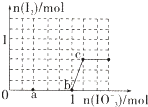 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A、还原性:HSO3->I-,氧化性:IO3->I2>SO42- |
| B、a点处的氧化产物是SO42-,还原产物是I- |
| C、当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol |
| D、若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2,+5SO42-+3H++H2O |
 滴液漏斗已知:R-OH+HX→R-X+H2O
滴液漏斗已知:R-OH+HX→R-X+H2O