题目内容
 滴液漏斗已知:R-OH+HX→R-X+H2O
滴液漏斗已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.有关数据见表:
乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g?cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
a减少副产物烯和醚的生成b.减少Br2的生成c减少HBr的挥发d.水是反应的催化剂
(2)加热的目的是
(3)为除去产品中的一种主要杂质,最好选择下列溶液来洗涤产品.
A.氢氧化钠 B.碘化钠 C.亚硫酸钠
(4)第(3)步的实验所需要的主要玻璃仪器是
考点:溴乙烷的制取
专题:有机物的化学性质及推断
分析:(1)加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等;
(2)加热时加快反应速率蒸出溴乙烷;
(3)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(4)洗涤需要在分液装置中进行,依据分液需要的仪器分析判断;
(2)加热时加快反应速率蒸出溴乙烷;
(3)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(4)洗涤需要在分液装置中进行,依据分液需要的仪器分析判断;
解答:
解:(1)反应中加入少量的水,防止反应进行时发生大量的泡沫,减少副产物乙醚的生成和避免HBr的挥发,故abc正确;
故答案为:a、b、c;
(2)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来;为了控制温度,应采取水浴加热,
故答案为:升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动;水浴加热;
(3)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.除去溴乙烷中的少量杂质Br2,加碘化亚铁会引入碘单质杂质 故B错误;
C.加亚硫酸钠只与溴反应不与溴乙烷反应,故c正确;
D.碳酸氢钠溶液呈碱性,和溴单质、溴乙烷反应,故D错误;
故选C;
(4)洗涤产品分离混合物需要在分液装置中,需要的仪器为分液漏斗,烧杯,遵循“上吐下泻”原则;
故答案为:分液漏斗、烧杯.
故答案为:a、b、c;
(2)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来;为了控制温度,应采取水浴加热,
故答案为:升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动;水浴加热;
(3)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.除去溴乙烷中的少量杂质Br2,加碘化亚铁会引入碘单质杂质 故B错误;
C.加亚硫酸钠只与溴反应不与溴乙烷反应,故c正确;
D.碳酸氢钠溶液呈碱性,和溴单质、溴乙烷反应,故D错误;
故选C;
(4)洗涤产品分离混合物需要在分液装置中,需要的仪器为分液漏斗,烧杯,遵循“上吐下泻”原则;
故答案为:分液漏斗、烧杯.
点评:本题考查了溴乙烷制备的反应原理和过程分析,物质性质的应用和装置的特征应用是解题关键,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列对于某些离子的检验说法中正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ |
| C、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| D、可用焰色反应实验检验溶液中是否含有K+ |
下列离子方程式正确的是( )
| A、向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉Fe+4H++N03-═Fe3++NO↑+2H2O |
| B、少量SO2通入Ca(ClO)2溶液中SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| C、漂白粉溶液在空气中失效ClO-+CO2+H2O═HClO+HCO3- |
| D、Ba(OH)2溶液中滴加NaHSO4溶液至中性Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
5.6g铁粉与一定量的硫磺混合,在空气中加热发生剧烈反应,冷却后用足量的盐酸溶解反应后的残留固体,产生了2.OL气体(标准状况),通过分析小于了应生成的气体量,其最可能原因是( )
| A、硫磺量不足 |
| B、生成了FeS |
| C、生成了Fe2S3 |
| D、有部分Fe被空气中的氧氧化了 |
在盛有溴水的试管中,加入少量CCl4后振荡,静置片刻后( )
| A、整个溶液变橙红色 |
| B、整个溶液变为紫红色 |
| C、上层为无色,下层为橙红色 |
| D、下层无色,上层紫红色 |
下列说法正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、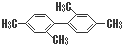 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol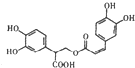 有机物 一定条件下能和7molNaOH反应 有机物 一定条件下能和7molNaOH反应 |
 A、B、C、D均为含硅的化合物,其中B的水溶液俗称水玻璃,其相互转化关系如图所示.
A、B、C、D均为含硅的化合物,其中B的水溶液俗称水玻璃,其相互转化关系如图所示.