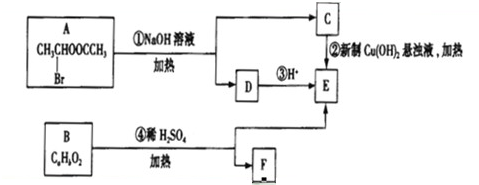
题目内容
工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K= (填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: .
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为 .
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,电极反应和电池反应方程式
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)根据平衡常数表达式结合三段式计算化学平衡常数;
(2)根据盖斯定律来书写热化学方程式;
(3)燃料电池中,燃料做负极.
(2)根据盖斯定律来书写热化学方程式;
(3)燃料电池中,燃料做负极.
解答:
解:(1)利用三段式计算,
C0+H2O(g)?CO2 +H2,
初始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.28 0.12 0.12
化学平衡常数K=
=
=1,
故答案为:1;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
根据盖斯定律(①+②)×
,得:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(3)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
故答案为:2NH3-6e-+6OH-=N2+6H2O.
C0+H2O(g)?CO2 +H2,
初始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.28 0.12 0.12
化学平衡常数K=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.12×0.12 |
| 0.08×0.28 |
故答案为:1;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
根据盖斯定律(①+②)×
| 1 |
| 2 |
故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(3)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评:本题主要考查了化学平衡常数的计算、盖斯定律的应用、原电池电极反应的书写等知识,中等难度,答题时注意化学原理知识的灵活运用.

练习册系列答案
相关题目
5.6g铁粉与一定量的硫磺混合,在空气中加热发生剧烈反应,冷却后用足量的盐酸溶解反应后的残留固体,产生了2.OL气体(标准状况),通过分析小于了应生成的气体量,其最可能原因是( )
| A、硫磺量不足 |
| B、生成了FeS |
| C、生成了Fe2S3 |
| D、有部分Fe被空气中的氧氧化了 |
在盛有溴水的试管中,加入少量CCl4后振荡,静置片刻后( )
| A、整个溶液变橙红色 |
| B、整个溶液变为紫红色 |
| C、上层为无色,下层为橙红色 |
| D、下层无色,上层紫红色 |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A、该条件下此反应的化学平衡常数约为0.91 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、B的转化率为60% |
| D、若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为确认溶液组成进行如下实验:(1)取上述溶液进行焰色反应,火焰呈黄色;(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是( )
| A、一定存在SO42-、CO32-、NH4+、Na+,可能存在K+、Cl- |
| B、一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+ |
| C、一定存在SO42-、CO32-、NH4+、Na+、Cl-,可能存在K+ |
| D、c(CO32-)=0.01 mol?L-1,c(NH4+)>c(SO42-) |
下列说法正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、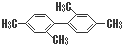 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol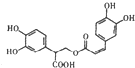 有机物 一定条件下能和7molNaOH反应 有机物 一定条件下能和7molNaOH反应 |