题目内容
下列能说明可逆反应2A(g)+B(g)?2C(g)+D(g)在一定条件下已达到化学平衡状态的事实是( )
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、C的生成速率是D的生成速率的两倍 |
| D、A的消耗速率是D的消耗速率的两倍 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、两边气体化学计量数相等,容器内压强始终不随时间的变化而变化,故A错误;
B、可逆反应始终是反应物和生成共存的状态,故B错误;
C、只体现正向,没有体现正逆的关系,故C错误;
D、A的消耗速率等效于D的生成速率,与D的消耗速率相等,反应达到平衡状态,故D正确;
故选D.
B、可逆反应始终是反应物和生成共存的状态,故B错误;
C、只体现正向,没有体现正逆的关系,故C错误;
D、A的消耗速率等效于D的生成速率,与D的消耗速率相等,反应达到平衡状态,故D正确;
故选D.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉Fe+4H++N03-═Fe3++NO↑+2H2O |
| B、少量SO2通入Ca(ClO)2溶液中SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| C、漂白粉溶液在空气中失效ClO-+CO2+H2O═HClO+HCO3- |
| D、Ba(OH)2溶液中滴加NaHSO4溶液至中性Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A、该条件下此反应的化学平衡常数约为0.91 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、B的转化率为60% |
| D、若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为确认溶液组成进行如下实验:(1)取上述溶液进行焰色反应,火焰呈黄色;(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是( )
| A、一定存在SO42-、CO32-、NH4+、Na+,可能存在K+、Cl- |
| B、一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+ |
| C、一定存在SO42-、CO32-、NH4+、Na+、Cl-,可能存在K+ |
| D、c(CO32-)=0.01 mol?L-1,c(NH4+)>c(SO42-) |
下列图象不符合事实是( )


| A、图①:pH相同的H2S溶液、稀H2SO4溶液、H2SO3溶液露置于空气中一段时间后,溶液的pH随时间的变化情况 |
| B、图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 |
| C、图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 |
| D、图④知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)kJ?mol-1 |
下列说法正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、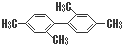 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol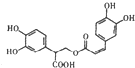 有机物 一定条件下能和7molNaOH反应 有机物 一定条件下能和7molNaOH反应 |
含有一个双键的烯烃,加氢后产物的键线式为 ,这种烯烃有( )
,这种烯烃有( )
 ,这种烯烃有( )
,这种烯烃有( )| A、3种 | B、5种 | C、7种 | D、8种 |
已知下列几个反应的化学方程式:下列有关物质的氧化性的强弱排列顺序中正确的是( )
①2KI+Cl2═2KCl+I2;
②2FeCl2+Cl2═2FeCl3;
③2FeCl3+2HI═2FeCl2+I2+2HCl;
④I2+SO2+2H2O═H2SO4+2HI.
①2KI+Cl2═2KCl+I2;
②2FeCl2+Cl2═2FeCl3;
③2FeCl3+2HI═2FeCl2+I2+2HCl;
④I2+SO2+2H2O═H2SO4+2HI.
| A、Cl2>Fe3+>I2>SO2 |
| B、Cl2>I2>Fe3+>SO2 |
| C、Cl2>Fe3+>SO2>I2 |
| D、Fe3+>I2>Cl2>SO2 |
