题目内容
14.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出].附图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )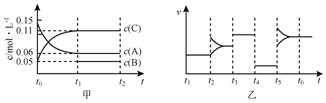
| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |
分析 t3~t4阶段为使用催化剂,t4~t5阶段改变条件平衡不移动,改变温度或某一组分浓度,平衡发生移动,故t4时改变的条件为减小压强,说明反应前后气体的体积相等,且反应速率减小,应是降低压强.t5时正逆反应速率都增大,应是升高温度,t2时正、逆反应速率中只有其中一个增大,应是改变某一物质的浓度.
由图甲可知,t1时到达平衡,△c(A)=0.09mol/L,△c(C)=0.06mol/L,二者化学计量数之比为0.09:0.06=3:2,则B为生成物,反应方程式为:3A(g)?B(g)+2C(g).
A.根据v=$\frac{△c}{△t}$计算v(A);
B.t4~t5阶段改变的条件是降低压强;
C.由方程式可知△c(B)=$\frac{1}{2}$△c(C),B的起始浓度=B的平衡浓度-△c(B),再根据n=cV计算;
D.t5~t6阶段为升高温度,容器内A的物质的量减少了0.03mol,说明平衡正向移动,正反应为吸热反应,
应是升高温度,3mol A反应放出的吸收的热量为akJ×$\frac{3mol}{0.03mol}$=100akJ,注明物质聚集状态与反应热书写热化学方程式.
解答 解:t3~t4阶段为使用催化剂,t4~t5阶段改变条件平衡不移动,改变温度或某一组分浓度,平衡发生移动,故t4时改变的条件为减小压强,说明反应前后气体的体积相等,且反应速率减小,应是降低压强.t5时正逆反应速率都增大,应是升高温度,t2时正、逆反应速率中只有其中一个增大,应是改变某一物质的浓度.
由图甲可知,t1时到达平衡,△c(A)=0.09mol/L,△c(C)=0.06mol/L,二者化学计量数之比为0.9:0.6=3:2,则B为生成物,反应方程式为:3A(g)?B(g)+2C(g).
A.若t1=15 s,t0~t1段△c(A)=0.9mol/L,则v(A)=$\frac{0.09mol/L}{15s}$=0.006mol/(L.s),故A错误;
B.t4~t5阶段改变的条件是降低压强,故B错误;
C.由方程式可知△c(B)=$\frac{1}{2}$△c(C)=0.03mol/L,B的起始浓度=0.05mol/L-0.03mol/L=0.02mol/L,该容器的容积为2 L,B的起始物质的量为2L×0.02mol/L=0.02 mol,故C正确;
D.t5~t6阶段为升高温度,容器内A的物质的量减少了0.03mol,说明平衡正向移动,正反应为吸热反应,
应是升高温度,3mol A反应放出的吸收的热量为akJ×$\frac{3mol}{0.03mol}$=100akJ,反应热化学方程式为:3A (g)?2C(g)+B(g)△H=+100akJ/mol,故D错误,
故选C.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、反应速率计算、热化学方程式书写等,关键是根据图象综合分析各阶段改变条件、确定反应方程式,题目难度中等.

 名校课堂系列答案
名校课堂系列答案①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H1
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H2
H2O(g)═H2O(l)△H3
②Ba(OH)2(aq)+H2SO4(浓,aq)═BaSO4(s)+2H2O(l)△H4
Ba(OH)2(aq)+2HNO3(aq)═Ba(NO3)2(aq)+2H2O(l)△H5.
| A. | △H1<△H2;△H4=△H5 | B. | △H1>△H2;△H4>△H5 | ||
| C. | △H2=△H1+6△H3;△H4>△H5 | D. | △H1>△H2;△H4<△H5 |
| A. | 0.1 mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| C. | 1 mol甲苯含有6NA个C-H键 | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
| A. | 与铝反应放出H2的溶液Na+、NH4+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42-、I? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42- |
| A. | 还原铁粉可用作食品袋内的抗氧化剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 碳酸钠可用于治疗胃酸过多 |
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| B. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ/mol 则稀硫酸溶液与稀氢氧化钡溶液反应的反应热△H=2×(-57.3)kJ/mol | |
| D. | 相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量 |
