题目内容
19.下列两组热化学方程式中,有关△H的关系正确的是( )①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H1
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H2
H2O(g)═H2O(l)△H3
②Ba(OH)2(aq)+H2SO4(浓,aq)═BaSO4(s)+2H2O(l)△H4
Ba(OH)2(aq)+2HNO3(aq)═Ba(NO3)2(aq)+2H2O(l)△H5.
| A. | △H1<△H2;△H4=△H5 | B. | △H1>△H2;△H4>△H5 | ||
| C. | △H2=△H1+6△H3;△H4>△H5 | D. | △H1>△H2;△H4<△H5 |
分析 物质的燃烧反应是放热的,焓变小于零,根据该盖斯定律计算反应焓变之间的关系即可.
A.水从气态变成液态放热,形成沉淀放热;
B.放热焓变小于零,形成硫酸钡放热;
C.根据该盖斯定律计算反应焓变之间的关系;
D.△H1形成气态水,△H2形成液态水,△H4比△H5形成沉淀.
解答 解:A.物质的燃烧反应是放热的,焓变小于零,△H1<0,△H2<0,水从气态变成液态放热,△H1>△H2,△H4<△H5,故A错误;
B.中和反应放热,形成沉淀,放出的热量更多,所以△H4<△H5,故B错误;
C.已知,Ⅰ2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H1
ⅡH2O(g)═H2O(l)△H3由盖斯定律Ⅰ+Ⅱ×6得到2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H2=△H1+6△H3,但△H4<△H5,故C错误;
D.水从气态变成液态放热,△H1>△H2,中和反应放热,形成沉淀,放出的热量更多,所以△H4<△H5,故D正确;
故选D.
点评 本题考查△H大小比较,涉及盖斯定律的应用以及反应热的判断,注意盖斯定律的应用,把握已知反应与目标反应的关系为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
9.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | NCl3 | B. | BF3 | C. | SF6 | D. | HCl |
10.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下.下列说法不正确的是( ) 

| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| C. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 电子迁移方向:电极a→导线→电极b→电解质溶液→电极a |
7.下列有关原子结构和元素周期律的叙述正确的是( )
| A. | 稀有气体不活泼是因为它们原子最外层都达到8e-稳定结构 | |
| B. | 原子序数为12的元素位于元素周期表的第三周期ⅡA族 | |
| C. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 | |
| D. | ⅦA族元素是同周期主族元素中原子半径最大的 |
14. H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )
 H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )| A. | 电池工作时,电子从电极a经负载流向电极b | |
| B. | 实际工作中当反应生成64gS2时,电池内部释放632kJ电能 | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 当电路中通过4mol电子时,有4mol H+经质子膜进入正极区 |
4.下列有关实验的说法错误的是( )
| A. | 向MgCl2溶液中滴加少量NaOH溶液,产生白色沉淀,再滴加FeCl3溶液,沉淀逐渐变为红褐色 | |
| B. | 氯化亚铁不能通过化合反应制得 | |
| C. | 用0.1mol/L的酸性KMnO4溶液配成的溶液滴定一定质量的草酸晶体(H2C2O4•nH2O)以测定其n值,若终点仰视读数,则n值偏小 | |
| D. | 将稀硫酸由室温加热至80℃(忽略溶液体积变化),其pH不变 |
11.一种污水处理的装置如图所示,甲池中生成的Fe(OH)3具有很强的吸附性,可吸附污物而沉淀下来,使污水得到净化;为使污水处理顺利进行,工作时污水的pH需保持在5.0~6.0之间.下列说法错误的是( )

| A. | 甲池为电解池,乙池为原电池 | |
| B. | 工作时需不断地向甲池中加入H2O2 | |
| C. | a电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| D. | 工作时需不断地向甲池中加入适量烧碱溶液 |
13.设NA 表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100mL 0.1mol•L-1的稀硫酸中含有SO42-个数为0.1NA | |
| B. | 含1 mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2 NA | |
| C. | 4℃时,5.4mL水中所含的水分子数是0.3NA | |
| D. | 标准状况下,22.4L氢气所含的质子数为NA |
14.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出].附图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
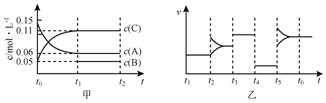

| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |