题目内容
6.下列说法正确的是( )| A. | 还原铁粉可用作食品袋内的抗氧化剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 碳酸钠可用于治疗胃酸过多 |
分析 A.食品抗氧化剂要能与氧气反应;
B.常温下铝遇浓硝酸发生钝化;
C.明矾溶于水生成胶状物可吸附悬浮于水中的杂质;
D.碳酸钠水解呈碱性,碱性较强.
解答 解:A.还原性铁粉易与氧气反应,可作食品抗氧化剂,故A正确;
B.常温下能用铝制容器盛放浓硝酸和浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应,故B错误;
C.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起消毒杀菌的作用,故C错误;
D.碳酸钠碱性太强,不能用作胃药,一般用碳酸氢钠,故D错误;
故选A.
点评 本题考查物质的性质及应用,为高频考点,侧重于化学与生活的考查,熟悉相关物质的成分及性质是解题关键,有利于培养学生良好的科学素养,提高学习的积极性,题目难度不大.

练习册系列答案
相关题目
11.一种污水处理的装置如图所示,甲池中生成的Fe(OH)3具有很强的吸附性,可吸附污物而沉淀下来,使污水得到净化;为使污水处理顺利进行,工作时污水的pH需保持在5.0~6.0之间.下列说法错误的是( )

| A. | 甲池为电解池,乙池为原电池 | |
| B. | 工作时需不断地向甲池中加入H2O2 | |
| C. | a电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| D. | 工作时需不断地向甲池中加入适量烧碱溶液 |
17.根据表信息,下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | |
| ② | KMnO4 | H2O2 | O2 | MnO2 |
| ③ | KClO3 | 浓盐酸 | Cl2 | |
| ④ | KMnO4 | 浓盐酸 | Cl2 | MnCl2 |
| A. | 表中①反应的氧化产物只能有FeCl3 | |
| B. | 表中②生成1mol的O2将有4mol的电子转移 | |
| C. | 还原性比较:H2O2>Mn2+>Cl- | |
| D. | 表中④的离子方程式配平后,H+的化学计量数为16 |
14.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出].附图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
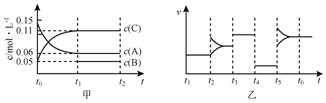

| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |
11.下列离子方程式书写正确的是( )
| A. | FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O |
18.下列物质中既能与盐酸反应又能与氢氧化钠溶液反应的是( )
①NaHCO3②Al③Al2O3④Al(OH)3⑤CO2⑥AlCl3.
①NaHCO3②Al③Al2O3④Al(OH)3⑤CO2⑥AlCl3.
| A. | ②③④⑤ | B. | ①②④⑥ | C. | ①②③④ | D. | 全部 |
16.化学与社会科学、技术、环境、生活等有密切关系.下列说法正确的是( )
| A. | 有机玻璃受热软化,易于加工成形,是一种硅酸盐材料 | |
| B. | 常用的灭火器成分有干冰、四氯化碳等 | |
| C. | 生活中常见的金属镁、铝均能通过热还原法冶炼 | |
| D. | 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用 |