题目内容
7. X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.请回答下列问题:
(1)X2分子中σ键和π键数目比是1:2.
(2)下列有关X、Y、W的说法正确的是①②④.
①Y的第一电离能在同族元素中最大
②常温下,Y的氢化物分子间存在氢键
③XY3-中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(3)将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程式是4NH3+2Cu(OH)2=[Cu(NH3)4]2++2OH-.
(4)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是4Na2O2+4Fe2++6H2O=4Fe(OH)3+O2↑+8Na+.
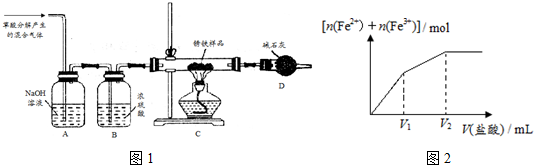
(5)R晶体的晶胞结构如图所示,该晶胞中所含的原子个数是4,R原子的配位数为12,若R晶体的密度为 d g.cm-3,则R原子的半径为2$\root{3}{\frac{\sqrt{2}}{d{N}_{A}}}$×109pm.
分析 X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,则X原子核外有7个电子,为N元素;
Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,则Y是O元素、Z是S元素;
W3+的基态离子3d轨道为半充满状态,则W原子核外有Fe元素;
R的氢氧化物悬浊液可用于检验葡萄糖的存在,则R为Cu元素;
(1)每个N2分子中含有1个σ键和2个π键;
(2)①同一主族元素,元素的第一电离能随着原子序数增大而减小;
②N、O、F元素的氢化物中都含有氢键;
③NO3-中N原子价层电子对个数=3+$\frac{5+1-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断N原子杂化方式;
④Fe属于d区的元素;
(3)将N的气态氢化物的水溶液滴入Cu的氢氧化物悬浊液中,可得深蓝色溶液,二者反应生成铜铵络合物;
(4)将Na2O2与Fe2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,红褐色沉淀是氢氧化铁、无色气体是氧气,根据反应物和生成物书写该反应的离子方程式;
(5)该晶体中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
R原子的配位数=3×8÷2,设该晶胞中Cu原子半径为xcm,则晶胞棱长=2$\sqrt{2}$xcm,晶胞体积=(2$\sqrt{2}$xcm)3,
ρ=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,则X原子核外有7个电子,为N元素;
Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,则Y是O元素、Z是S元素;
W3+的基态离子3d轨道为半充满状态,则W原子核外有Fe元素;
R的氢氧化物悬浊液可用于检验葡萄糖的存在,则R为Cu元素;
(1)每个N2分子中含有1个σ键和2个π键,则X2分子中σ键和π键数目比是1:2,故答案为:1:2;
(2)①同一主族元素,元素的第一电离能随着原子序数增大而减小,所以在O族元素中,O元素的第一电离能最大,故正确;
②N、O、F元素的氢化物中都含有氢键,所以水中含有氢键,故正确;
③NO3-中N原子价层电子对个数=3+$\frac{5+1-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断N原子杂化方式为sp2,故错误;
④Fe属于d区的元素,故正确;
故选①②④;
(3)将N的气态氢化物的水溶液滴入Cu的氢氧化物悬浊液中,可得深蓝色溶液,二者反应生成铜铵络合物,离子方程式为4NH3+2Cu(OH)2=[Cu(NH3 )4]2++2OH-,故答案为:4NH3+2Cu(OH)2=[Cu(NH3 )4]2++2OH-;
(4)将Na2O2与Fe2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,红褐色沉淀是氢氧化铁、无色气体是氧气,根据反应物和生成物书写该反应的离子方程式为4Na2 O2+4Fe2++6H2 O=4Fe(OH)3+O2↑+8Na+,
故答案为:4Na2 O2+4Fe2++6H2 O=4Fe(OH)3+O2↑+8Na+;
(5)该晶体中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
R原子的配位数=3×8÷2=12,设该晶胞中Cu原子半径为xcm,则晶胞棱长=2$\sqrt{2}$xcm,晶胞体积=(2$\sqrt{2}$xcm)3,
ρ=$\frac{\frac{M}{{N}_{A}}×4}{V}$,则dg.cm-3=$\frac{\frac{64}{{N}_{A}}×4}{(2\sqrt{2}x)^{3}}$g.cm-3=$\frac{8\sqrt{2}}{{N}_{A}{x}^{3}}$g.cm-3,x=2$\root{3}{\frac{\sqrt{2}}{d{N}_{A}}}$cm=2$\root{3}{\frac{\sqrt{2}}{d{N}_{A}}}$×109pm,
故答案为:4; 12;2$\root{3}{\frac{\sqrt{2}}{d{N}_{A}}}$×109.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氧化还原反应、元素周期律等知识点,侧重考查学生分析判断及计算能力,明确物质结构、基本原理是解本题关键,难点是晶胞计算,注意该晶胞中对角线上的三个原子紧密相连,题目难度中等.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 3n-10 | B. | 10-3n | C. | 3n-12 | D. | 12-3n |
| A. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用KMnO4酸性溶液鉴别正丙醇和丙醛 |
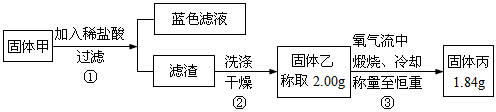
已知,氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,Cu在氧气流中锻烧,可以转化为氧化铜.硫化铜和硫化亚铜常温下都不溶于稀盐,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
下列用关说法正确的是( )
| A. | 加盐酸有蓝色溶液生成,说明固体甲中一定含有氧化铜 | |
| B. | 步骤①所得滤渣中肯定含有单质铜 | |
| C. | 固体甲中若存在Cu2O,也可能有Cu2S | |
| D. | 固体甲中,CuS和Cu2S不能同时存在 |
| A. | Na>Mg>Al | B. | Al>Mg>Na | C. | Mg>Al>Na | D. | Na>Al>Mg |
 某兴趣小组设计出如图装置(气密性已检查),验证铜与稀硝酸反应的产物,已知:FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
某兴趣小组设计出如图装置(气密性已检查),验证铜与稀硝酸反应的产物,已知:FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.