题目内容
16.等质量的Na、Mg、Al三种金属与足量稀硫酸反应,在标准状况下生成的氢气由多到少的顺序是( )| A. | Na>Mg>Al | B. | Al>Mg>Na | C. | Mg>Al>Na | D. | Na>Al>Mg |
分析 设各金属的物质的量为1mol,完全反应时失去电子的物质的量分别为1mol、2mol、3mol,然后根据电子守恒计算出生成氢气的物质的量之比,相同条件下气体的体积之比等于物质的量之比,进而可以判断生成氢气量的大小.
解答 解:相同状况下,生成氢气体积之比等于其物质的量之比,假设Na、Mg、Al、Zn的物质的量都是1mol,完全反应时失去电子的物质的量分别为1mol、2mol、3mol,生成1mol氢气得到电子2mol,根据氧化还原反应中转移电子相等可知,生成氢气的物质的量之比为:$\frac{1mol}{2}$:$\frac{2mol}{2}$:$\frac{3mol}{2}$=1:2:3,当它们等质量时生成氢气的物质的量之比为:$\frac{1}{9}:\frac{1}{12}:\frac{1}{23}$,故生成氢气的物质的量由多到少的顺序Al>Mg>Na,故选B.
点评 本题考查了金属与酸的化学计算,题目难度不大,明确常见金属与酸反应的实质为解答关键,注意掌握电子守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
1.把6.2gNa2O溶于93.8g水中;把4.6g金属钠溶于95.6g水中;把7.8gNa2O2溶于93.8g水中,把8gNaOH溶于92g水中.得到的溶液的质量分数( )
| A. | 都是8% | B. | 分别为8%、8%、7%、10% | ||
| C. | 都是9% | D. | 分别为6%、7%、8%、10% |
11.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L乙烷的分子数为NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 23g钠的原子最外层电子数为2NA | |
| D. | 1mol甲基所含质子数为10NA |
6.下列固体不是白色的是( )
| A. | Fe2O3 | B. | NaHCO3 | C. | Al2O3 |
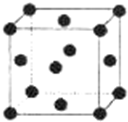 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.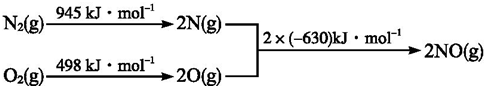

 +HNO3(浓)$→_{△}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.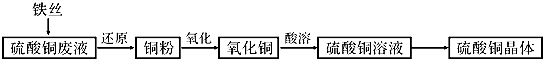
 是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
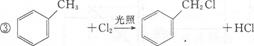
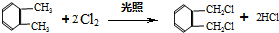 .
.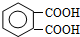 +2CH3CH2OH
+2CH3CH2OH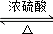
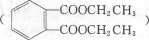 +2H2O.
+2H2O.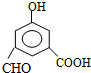 ,每种同分异构体中,化学环境不同的氢原子都是6种.
,每种同分异构体中,化学环境不同的氢原子都是6种.