题目内容
1.已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)═2NH3(g)△H=-92kJ•mol-1请回答下列问题:
(1)取1mol N2(g)和3molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量小于92kJ(填“大于”、“等于”或“小于”),原因是由于是可逆反应,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为2mol的氨气,所以放出热量一定小于92.0 kJ;若升高温度,上述反应中△H不变 (填“变大”、“变小”或“不变”).
(2)已知:分别破坏1molN-H键、1mol H-H键需要吸收的能量为:391kJ、436kJ,则破坏1mol N≡N键需要吸收的能量为946 kJ/mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g) 并发生上述反应.半分钟后反应达到平衡,测得v(NH3)=0.40mol/(L•min),则上述合成氨反应的平衡常数为$\frac{100}{3}$.
(4)向三个体积均为1L的恒容密闭容器中分别充入1molN2和3molH2,当分别只改变其中一个外界条件时使反应达到平衡,测得氨的体积分数随时间的变化如图所示.
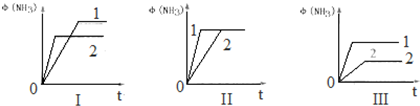
上述图象中,只改变温度的为Ⅰ(填“I”“II”“III”,下同),只改变压强的为Ⅲ,只改变催化剂的为Ⅱ.
(5)若把标准状况下8.96L氨气通入到100g9.8%的硫酸溶液中并完全吸收,所得溶液中离子浓度从大到小的顺序是c(NH+)>c(SO42-)>c(OH-)>c(H+).
(6)常温下,向浓度均为0.1mol/L的MgCl2、FeCl3和AlCl3混合溶液中通入NH3至过量,最先生成沉淀的化学式为Fe(OH)3,当pH=6时,开始生成Mg(OH)2沉淀.
(已知:Ksp[Mg(OH)2]=1.0×10-13; Ksp[Fe(OH)3]=1.0×10-40;Ksp[Al(OH)3]=1.0×10-33)
分析 (1)N2 和H2反应生成2mol NH3时放出的热量为92.0kJ,是指1mol氮气和1mol的氢气完全反应生成2mol的氨气放出的热量为92.0kJ,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为氨气,反应热△H与物质的化学计量数有关,由此分析解答;
(2)热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算出断开1mol N≡N键吸收的能量;
(3)化学平衡常数=生成物浓度幂之积与反应物浓度幂之积的比;
(4)根据勒夏特列原理和图象进行分析;
(5)氨气和酸反应生成对应的盐,根据水解解原理、电离原理来比较离子浓度的大小;
(6)物质的溶度积越小,越易形成沉淀;
解答 解:(1)N2 和H2反应生成2mol NH3时放出的热量为92.0kJ,是指1mol氮气和1mol的氢气完全反应生成2mol的氨气放出的热量为92.0kJ,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.0 kJ,反应热△H与物质的化学计量数有关,物质的化学计量数不变,热化学方程式中反应热不变,
故答案为:小于;由于是可逆反应,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为2mol的氨气,所以放出热量一定小于92.0 kJ;不变;
(2)设N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.0kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.0kJ/mol
解得:x=946 kJ/mol,
故答案为:946 kJ/mol;
(3)平衡时,2NH3(g)?N2(g)+3H2(g)
开始(mol/L) 0.5 0 0
转化(mol/L) 0.5×0.40 0.1 0.3
平衡(mol/L) 0.3 0.1 0.3
K=$\frac{c({N}_{2})•{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$=$\frac{0.1×0.{3}^{3}}{0.{3}^{2}}$;
则上述合成氨反应的平衡常数K=$\frac{0.{3}^{2}}{0.1×0.{3}^{3}}$=$\frac{100}{3}$
故答案为:$\frac{100}{3}$
(4)图象Ⅰ是改变温度,升温反应速率加快,达到平衡时间短,反应放热,平衡逆向移动,故T2>T1;
图象Ⅱ是加催化剂,催化剂只改变反应速率,平衡状态不改变;
图象Ⅲ改变压强,增大压强反应速率加快,平衡正向移动,故P1>P2.
故答案为:Ⅰ;Ⅲ;Ⅱ;
(5)标准状况下8.96L氨气即0.4mol氨气通入到100g9.8%的硫酸溶液即0.1mol的硫酸溶液中:生成0.1mol(NH4)2SO4,过量0.2molNH3•H2O,所以c(NH+)最大,c(H+)最小,所得溶液中离子浓度从大到小的顺序是c(NH+)>c(SO42-)>c(OH-)>c(H+),
故答案为:c(NH+)>c(SO42-)>c(OH-)>c(H+);
(6)根据Al(OH)3、Mg(OH)2、Fe(OH)3的溶度积常数,在25℃下,向浓度均为0.1mol•L-1的AlCl3、MgCl2和FeCl3混合溶液中通入NH3至过量,三种离子开始沉淀时的OH-浓度分别是:$\root{3}{\frac{1.0×1{0}^{-40}}{0.1}}$=1.0×10-13<$\root{3}{\frac{1.0×1{0}^{-33}}{0.1}}$=2.15×10-11<$\sqrt{\frac{1.0×1{0}^{-13}}{0.1}}$=1.0×10-6,加入相同的浓度的氨水,Fe(OH)3最先析出;pH=-lg(1.0×10-6)=6,故当pH=6时,开始生成Mg(OH)2沉淀,
故答案为:Fe(OH)3;6.
点评 题目综合性较大,涉及化学平衡的相关知识、从键能的角度计算反应热、溶度积计算等,难度中等.

| A. | 溴水 | B. | 氢硫酸 | C. | 品红试液 | D. | 紫色石蕊试液 |
| A. | 2,2-二甲基-3-乙基丁烷 | B. | 2-甲基-3-戊烯 | ||
| C. | 2-甲基-2-丙醇 | D. | 2-甲基-2-丁炔 |
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 乙苯 | D. | 2,2-二甲基丙烷 |
| A. |  | B. |  | C. |  | D. |  |
| A. | Na与乙醇反应时的反应速率比与水反应时的慢 | |
| B. | 除去乙烷中混有的少量乙烯的方法可以是将其通入溴的四氯化碳溶液中 | |
| C. | 已知 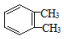 和 和 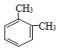 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 | |
| D. | .苯不能使酸性高猛酸钾溶液褪色,所以苯不能发生氧化反应 |