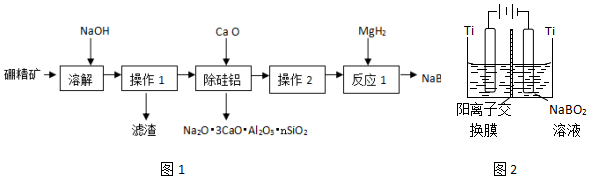
题目内容
6.把150mL98%的浓H2SO4(ρ=1.84g/cm3)与600mL的水混合成密度为1.225g/cm3的稀H2SO4,求该稀H2SO4的质量分数和物质的量浓度.分析 98%的浓H2SO4质量=150mL×1.84g/mL=276g,水的质量=600g,浓硫酸中硫酸的质量=276g×98%=270.48g
浓硫酸中n(H2SO4)=$\frac{276g×98%}{98}$=2.76mol,稀硫酸体积=$\frac{276+600}{1.225}$mL=715mL=0.715L,据此计算稀硫酸质量分数及物质的量浓度.
解答 解:98%的浓H2SO4质量=150mL×1.84g/mL=276g,水的质量=600g,浓硫酸中硫酸的质量=276g×98%=270.48g,浓硫酸中n(H2SO4)=$\frac{276g×98%}{98}$=2.76mol,稀硫酸体积=$\frac{276+600}{1.225}$mL=715mL=0.715L,稀硫酸质量分数=$\frac{270.48g}{276g+600g}$×100%=31%,稀硫酸的物质的量浓度=$\frac{2.76mol}{0.715L}$=3.86mol/L,
答:稀硫酸的质量分数为31%,稀硫酸的物质的量浓度为3.86mol/L.
点评 本题考查质量分数及物质的量浓度的有关计算,为高频考点,侧重考查学生分析、计算能力,明确各个物理量之间的关系是解本题关键,注意利用密度计算稀硫酸体积,稀硫酸体积不等于浓硫酸体积与水体积之和,为易错点.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
17.0.1mol/L Na2S溶液中,微粒间关系正确的是( )
| A. | [Na+]+[H+]=[OH-]+[HS-]+[S2-] | B. | [Na+]>[S2-]>[HS-]>[OH-] | ||
| C. | [Na+]=2[S2-]+2[HS-]+2[H2S] | D. | [Na+]>[HS-]>[S2-]>[OH-] |
15.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)-Q(Q>0),如果反应的平衡常数K值变大,该反应( )
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 在平衡移动时正反应速率先减小后增大 | |
| D. | 在平衡移动时逆反应速率先增大后减小 |
11. 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
15.下列说法不正确的是( )
| A. | 钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 | |
| B. | 硫酸铜溶液中加入足量铝粉,充分振荡溶液颜色将由蓝色变成无色,同时有红色物质析出 | |
| C. | 实现SO2→S的变化需要氧化剂才能实现 | |
| D. | 氯水具有杀菌、漂白作用是因氯水中含有强氧化性的次氯酸 |
16.下列各组中的反应,属于同一反应类型的是( )
| A. | 乙烷与氯气在光照下反应生成氯乙烷;乙烯与氯化氢反应生成氯乙烷 | |
| B. | 甲苯硝化生成对硝基甲苯;乙醇催化氧化生成乙醛 | |
| C. | 苯使溴水褪色;丙烯使溴水褪色 | |
| D. | 乙酸和乙醇生成乙酸乙酯;苯与液溴反应生成溴苯 |
 ,可简写为
,可简写为  .
. .
. .
. ,
, 的名称是1,3-丁二烯,写出1mol
的名称是1,3-丁二烯,写出1mol 与1mol Cl2发生加成反应的产物的结构简式:CH2=CH-CHClCH2Cl、ClCH2CH=CHCH2Cl.
与1mol Cl2发生加成反应的产物的结构简式:CH2=CH-CHClCH2Cl、ClCH2CH=CHCH2Cl. 也可按上述原理合成,它的合成原料是A.
也可按上述原理合成,它的合成原料是A.