题目内容
12.欲证明SO2具有氧化性,可将SO2通入( )| A. | 溴水 | B. | 氢硫酸 | C. | 品红试液 | D. | 紫色石蕊试液 |
分析 氧化还原反应中,所含元素化合价降低的反应物为氧化剂,表现氧化性,所含元素化合价升高的反应物为还原剂,表现还原性,据此分析解答.
解答 解:A.二氧化硫与溴水反应生成溴化氢和硫酸,硫元素化合价升高,二氧化硫表现还原性,故A不选;
B.二氧化硫与硫化氢反应生成硫单质,二氧化硫中+4价的硫降为0价,表现氧化性,故B选;
C.二氧化硫具有漂白性,能够使品红溶液褪色,与其氧化性无关,故C不选;
D.二氧化硫为酸性氧化性,能够与水反应生成亚硫酸,能够使紫色石蕊溶液变红,故D不选;
故选:B.
点评 本题考查了二氧化硫的性质,明确氧化性、还原性实质,熟悉二氧化硫的性质是解题关键,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
2.用盐酸滴定NaOH溶液的实验中,不必用到的是( )
| A. | 甲基橙 | B. | 圆底烧瓶 | C. | 锥形瓶 | D. | 滴定管 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.8g铁粉与50mL 4mol/L盐酸反应转移电子的数目为0.15NA | |
| B. | 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA | |
| C. | 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA | |
| D. | 1mol苯中所含碳碳双键的数目为3NA |
20.如图是模拟铁的电化学防护装置,不正确的叙述是( )
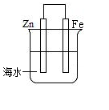

| A. | 此装置属于原电池 | |
| B. | 此装置中电子从铁经导线流向锌 | |
| C. | 此装置中的铁极上发生还原反应 | |
| D. | 该电化学防护法称为“牺牲阳极阴极保护法” |
7.下列现象与氧化还原反应无关的是( )
| A. | 钢铁生锈 | B. | 食物变质 | C. | 溶洞形成 | D. | 氯气消毒 |
17.0.1mol/L Na2S溶液中,微粒间关系正确的是( )
| A. | [Na+]+[H+]=[OH-]+[HS-]+[S2-] | B. | [Na+]>[S2-]>[HS-]>[OH-] | ||
| C. | [Na+]=2[S2-]+2[HS-]+2[H2S] | D. | [Na+]>[HS-]>[S2-]>[OH-] |
4.用CO2、CO合成甲醇是碳减排的新方向,其发生的化学方程式如下:CO2+3H2?CH3OH+H2O;CO+2H2?CH3OH,若CO2和CO混合气共消耗H2 10mol,生成甲醇4mol,则参加反应的CO2是( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
1.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 煤的干馏可得到煤油、石蜡和沥青 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 氧化铝可用来制造耐高温的容器 | |
| D. | 装有硅胶的透气袋可防止富含油脂的月饼被氧化 |