题目内容
18.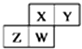 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物一定为强酸 |
分析 图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,则X、Y为第二周期元素,Z、W为第三周期元素,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小;
B.同周期非金属从左向右增强,同主族从上到下减弱,非金属性强的气态氢化物稳定;
C.W可能位于第VA族,最高价为+4价,最低价为-4价;
D.Z可能为Al.
解答 解:图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,则X、Y为第二周期元素,Z、W为第三周期元素,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径为Z>W>X>Y,故A错误;
B.同周期非金属从左向右增强,同主族从上到下减弱,非金属性强的气态氢化物稳定,气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.W可能位于第VA族,最高正化合价与负化合价的绝对值可能相等,故C正确;
D.Z可能为Al,最高价氧化物的水化物为弱碱,故D错误;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
8.下列有关硅及其化合物的说法治确的是( )
| A. | 单晶硅太阳能电池的光电转换效率为100% | |
| B. | 高溫下碳能将二氧化硅还原为硅,则C的非金属性比Si强 | |
| C. | Mg2Si与盐酸作用制得硅烷的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑ | |
| D. | 一种硅酸盐云母[KAl2(AlSi3O10)(OH)2用氧化物形式可表示为:K2O•3Al2O3•6SiO2•H2O |
6.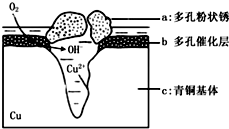 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )
如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )
 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )
如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )| A. | 腐蚀过程中,负极是 b 和 c | |
| B. | 生 成 Cu 2( OH )3 Cl 的 离子方程式为:2Cu2++3OH -═Cu 2( OH ) 3+ | |
| C. | 若生成 4.29gCu 2( OH )3 Cl,则理论上消耗标准状况氧气体积为0.448L | |
| D. | 正极的电极反应式为:O 2-4e-+2H+═2OH - |
13.某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验.实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
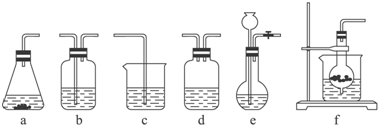
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好.
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):

请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
10.下列有关说法正确的是( )
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后pH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol/L | |
| C. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 | |
| D. | 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
 六种物质中:
六种物质中: