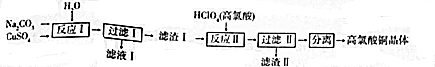题目内容
9.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作氧化剂;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,在酸性条件下亚硫酸钠能将其还原为+3价,写出反应的离子方程式Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是4Na+TiCl4$\frac{\underline{\;500℃\;}}{\;}$Ti+4NaCl.
分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,该反应中Ce元素化合价由+4价变为+3价、双氧水中O元素化合价由-1价变为0价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(2)+6价的Cr能引起细胞的突变,在酸性条件下亚硫酸钠能将其还原为+3价,S元素化合价由+4价变为+6价,同时生成水,根据反应物和生成物书写离子方程式;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,根据反应物、生成物和反应条件书写方程式.
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,该反应中Ce元素化合价由+4价变为+3价、双氧水中O元素化合价由-1价变为0价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,CeO2在反应中得电子作氧化剂,故答案为:氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4═Ti+4NaCl,
故答案为:4Na+TiCl4$\frac{\underline{\;500℃\;}}{\;}$Ti+4NaCl.
点评 本题考查化学方程式书写、氧化还原反应,为高频考点,明确物质性质与元素化合价关系是解本题关键,会根据反应物、生成物及反应条件书写方程式,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列涉及的实验方案或工业方案不能达到目的是( )
| A. | 用FeCl3溶液刻制铜材电路板 | |
| B. | 用乙醇作萃取剂从碘水中提取碘 | |
| C. | 在常温下用铝制容器贮运浓硫酸 | |
| D. | 向含硫高的煤中加入生石灰,可减少燃料对大气的污染 |
17.关于元素周期表的说法正确的是( )
| A. | 目前元素周期表有7个周期 | B. | 元素周期表有8个主族 | ||
| C. | ⅢA族元素全部是金属元素 | D. | 非金属元素都在ⅣA~ⅤⅡA和0族 |
4.下列化学式只能表示一种物质的是( )
| A. | CH2Cl2 | B. | C2H4Cl2 | C. | C4H5 | D. | C5H12 |
14.下列化合物中存在离子键的是( )
| A. | 氯化氢 | B. | 甲烷 | C. | 水 | D. | 硫化钠 |
1.相同质量的Na、Mg、Al分别与足量盐酸充分反应,生成氢气的质量比为( )
| A. | 1:2:3 | B. | 23:24:37 | C. | 23:12:9 | D. | 36:69:92 |
18.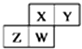 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物一定为强酸 |