题目内容
13.某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验.实验室提供的药品、仪器装置如下:药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
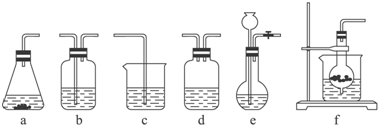
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
分析 制取NaHCO3溶液,要达到实验目的,应该先用能随开随用、随关随停的类启普发生器原理的装置f制取CO2气体,然后再通过盛有饱和KHCO3溶液的b装置以除去CO2中混有的HCl(原理是:KHCO3+HCl═KCl+CO2↑+H2O),最后再将足量的CO2通入稀NaOH溶液中即可(原理是:CO2+NaOH═NaHCO3).
(1)实验室常用石灰石和稀盐酸反应制取二氧化碳,该反应属于“固液不加热型”,用能随开随用、随关随停的类启普发生器原理的装置为f,通过盛有饱和KHCO3溶液的b装置以除去CO2中混有的HCl,将足量的CO2通入稀NaOH溶液中制得碳酸氢钠;
(2)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(3)碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,氯化氢易挥发,Y装置中除去的杂质为氯化氢;
(4)少量二氧化碳和氢氧化钠反应生成碳酸钠和水,过量二氧化碳和氢氧化钠反应生成碳酸氢钠;
(5)根据在常温(25℃)时的碳酸氢钠的溶解度表结合反应CO2+NaOH═NaHCO3计算NaOH的质量,然后求解.
解答 解:(1)装置f在制取气体时打开开关,由于装置内外压强相等,液体药品会从下端的管进入装置内,与装置内固体接触,反应开始,当关闭开关后,由于产生的气体不能排出,试管内气体压强越来越大,把液体从下端的管口压出,是液体与固体分离,反应停止,所以可以做到随开随用随关随停,所以用装置f制取CO2气体,然后再通过盛有饱和KHCO3溶液的b装置以除去CO2中混有的HCl(原理是:KHCO3+HCl═KCl+CO2↑+H2O),最后再将足量的CO2通入稀NaOH溶液中即可(原理是:CO2+NaOH═NaHCO3),
故答案为:
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | f | b | c |
| 选择的药品(填序号) | ②⑥ | ④ | ① |
(2)检验装置f的气密性,方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好,
故答案为:方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好;
(3)碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,所以装置f中发生化学反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,氯化氢易挥发,Y装置中除去的杂质为氯化氢,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;HCl;
(4)少量二氧化碳和氢氧化钠反应:CO2+2NaOH═Na2CO3+H2O,过量二氧化碳和氢氧化钠反应CO2+NaOH═NaHCO3,常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3,
故答案为:使溶液中的NaOH完全转化为NaHCO3;
(5)假设NaHCO3的饱和溶液中含100 g水,则由提供数据可知,此时溶液中NaHCO3的质量为9.60 g,据反应CO2+NaOH═NaHCO3可求得NaOH的质量为:$\frac{40×9.60g}{84}$=4.57 g,所以,NaOH溶液最大浓度w(NaOH)=$\frac{4.57g}{100g+457g}$×100%=4.37%,
故答案为:4.37.
点评 本题以制取NaHCO3溶液为载体考查性质实验方案设计,明确实验原理是解本题关键,侧重考查学生实验操作、分析能力,知道各个装置目的、作用、发生的反应及实验现象,注意化学用语的正确运用,题目难度中等.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案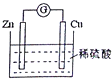
| A. | Zn片是正极 | |
| B. | 电池工作时,H+在铜片上得电子 | |
| C. | 电池工作时,电能转变为化学能,且锌片逐渐被消耗 | |
| D. | 电池工作时,电子从锌片通过硫酸溶液流向铜片 |
| A. | CH2Cl2 | B. | C2H4Cl2 | C. | C4H5 | D. | C5H12 |
| A. | 1:2:3 | B. | 23:24:37 | C. | 23:12:9 | D. | 36:69:92 |
[提出假设]
假设一:产生的气体可能是O 2.
假设二:产生的气体可能是N2、SO 2、CO 2 等气体.
(1 )请写出H2O 2氧化FeSO4的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
[实验设计]
为验证假设二是否成立,课题小组设计如下实验来验证气体成分.
所用试剂:H 2 O2 溶液、FeCl 2 溶液、KSCN 溶液、品红溶液、酸性高锰酸钾溶液、澄清石灰水、NaOH 溶液等.

请完成下表中的内容:
| 实验过程和现象 | 结论 |
| (2)试管A中盛有品红溶液现象:品红溶液褪色 | 证明气体中含有SO2 |
| (3)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅试管C中现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
(4 )根据题目中所给的信息及实验推断出物质还原性的强弱顺序:Fe2+>SCN-(填“>”或“<”),理由是向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明双氧水优先氧化Fe2+.
(5 )有同学认为:KSCN 被氧化的产物中可能还含有 SO 42-,请设计一个简单实验验证.
| 实验过程 | 实验现象及结论 |
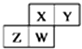 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物一定为强酸 |
| 牙膏品牌 | 青蛙儿童牙膏 | 佳洁士盐白牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
(1)上述三种摩擦剂中属于氧化物的是SiO2(填化学式,下同);
(2)青蛙儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)从摩擦剂成分考虑,向佳洁士盐白牙膏样品中滴加少量稀盐酸,可以观察到的现象是有气体生成,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;
(4)中华透明牙膏摩擦剂二氧化硅是工业制备晶体硅的原料.工业制备晶体硅的反应原理是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑(用化学反应方程式表示).