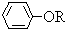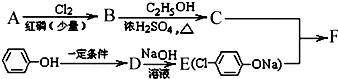题目内容
标准状况下将盛有12mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余1mL无色气体,则原混合气体中氧气的体积为 .
考点:氮的氧化物的性质及其对环境的影响
专题:元素及其化合物
分析:NO2和O2混合气体与反应可能的反应式有:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,根据反应的方程式用讨论的方法计算.
解答:
解:如氧气过量,则剩余1ml无色气体为氧气,设参加反应的氧气的体积为x,则有:
4NO2+O2+2H2O=4HNO3
4x x
4x+x=12mL-1mL=11mL,
x=2.2mL,所以氧气的体积为:2.2mL+1mL=3.2mL;
如NO2过量,则剩余1mL无色气体为NO,设氧气的体积为y,
4NO2+O2+2H2O=4HNO3
4y y
3NO2+H2O=2HNO3+NO
3 1
(12ml-y-4y) 1mL
y=1.8mL,
故答案为:3.2mL或1.8mL.
4NO2+O2+2H2O=4HNO3
4x x
4x+x=12mL-1mL=11mL,
x=2.2mL,所以氧气的体积为:2.2mL+1mL=3.2mL;
如NO2过量,则剩余1mL无色气体为NO,设氧气的体积为y,
4NO2+O2+2H2O=4HNO3
4y y
3NO2+H2O=2HNO3+NO
3 1
(12ml-y-4y) 1mL
y=1.8mL,
故答案为:3.2mL或1.8mL.
点评:本题考查混合物的计算,题目难度中等,注意气体的过量判断,结合方程式计算.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、硝酸的摩尔质量63g |
| B、1mol CO的体积约为22.4L |
| C、2g氢气所含原子数目为1mol |
| D、铁的摩尔质量在数值上等于铁原子的相对原子质量 |
解释下列现象的化学用语不正确的是( )
| A、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+1AlO2-+2H2O |
| B、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3?H2O |
| C、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪).关于185Hf的下列说法中,正确的是( )
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
 回答下列各题:
回答下列各题: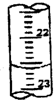 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下: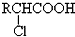 ;
;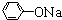 +RCl→NaCl+
+RCl→NaCl+