题目内容
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为: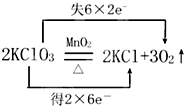 回答下列各题:
回答下列各题:
(1)该反应的基本类型为 .
(2)该反应中被还原的元素名称为 .
(3)式子“失6×2e-”中各数字的含义分别是 、 .
(4)从反应后的固体混合物中分离出难溶于水的MnO2操作方法:
(5)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)
A 氧化性 B还原性 C酸性
(6)以上两个反应都用到MnO2,其作用分别是 、 .
(7)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为 .
 回答下列各题:
回答下列各题:(1)该反应的基本类型为
(2)该反应中被还原的元素名称为
(3)式子“失6×2e-”中各数字的含义分别是
(4)从反应后的固体混合物中分离出难溶于水的MnO2操作方法:
(5)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓)
| ||
A 氧化性 B还原性 C酸性
(6)以上两个反应都用到MnO2,其作用分别是
(7)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为
考点:氧化还原反应
专题:
分析:(1)一种物质分解生成多种物质,属于分解反应;
(2)元素的化合价降低被还原;
(3)反应中6个氧原子失电子,每个失去2个电子;
(4)二氧化锰不溶于水,用过滤的方法分离;
(5)MnO2与浓盐酸反应生成氯气,HCl被氧化,同时生成盐氯化锰;
(6)氯酸钾和二氧化锰制取氧气时二氧化锰不参加反应,MnO2与浓盐酸反应生成氯气时二氧化锰中Mn元素的化合价降低;
(7)根据方程式分析计算.
(2)元素的化合价降低被还原;
(3)反应中6个氧原子失电子,每个失去2个电子;
(4)二氧化锰不溶于水,用过滤的方法分离;
(5)MnO2与浓盐酸反应生成氯气,HCl被氧化,同时生成盐氯化锰;
(6)氯酸钾和二氧化锰制取氧气时二氧化锰不参加反应,MnO2与浓盐酸反应生成氯气时二氧化锰中Mn元素的化合价降低;
(7)根据方程式分析计算.
解答:
解:(1)一种物质分解生成多种物质,属于分解反应,氯酸钾分解生成氯化钾和氧气属于分解反应;
故答案为:分解反应;
(2) 反应中,Cl元素的化合价从+5价降低到-1价,Cl元素的化合价降低被还原;故答案为:氯元素;
反应中,Cl元素的化合价从+5价降低到-1价,Cl元素的化合价降低被还原;故答案为:氯元素;
(3) 反应中O元素失电子,6个氧原子失电子12个电子,每个原子失去2个电子;
反应中O元素失电子,6个氧原子失电子12个电子,每个原子失去2个电子;
故答案为:6个氧原子;一个氧原子失去2个电子;
(4)氯酸钾和二氧化锰混合物加热,氯酸钾分解生成氯化钾,则反应后固体混合物为二氧化锰和氯化钾,加水溶解,二氧化锰不溶于水,然后过滤、洗涤、干燥,得到二氧化锰固体;
故答案为:溶解、过滤、洗涤、干燥;
(5)MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O中氧化物和单质写为分子形式,HCl和MnCl2拆为离子形式,其离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+H2O,HCl中Cl元素的化合价升高被氧化,同时生成盐氯化锰,则HCl表现出还原性和酸性;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+H2O;BC;
(6)氯酸钾和二氧化锰制取氧气时二氧化锰不参加反应,二氧化锰作催化剂,MnO2与浓盐酸反应生成氯气时二氧化锰中Mn元素的化合价降低,二氧化锰作氧化剂;
故答案为:催化剂;氧化剂;
(7) 的反应中生成3mol氧气转移12mol电子,MnO2+4HCl(浓)
的反应中生成3mol氧气转移12mol电子,MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O反应中,生成1mol氯气转移2mol电子,则转移1mol电子时生成6mol氯气,所以转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
故答案为:1:2.
故答案为:分解反应;
(2)
 反应中,Cl元素的化合价从+5价降低到-1价,Cl元素的化合价降低被还原;故答案为:氯元素;
反应中,Cl元素的化合价从+5价降低到-1价,Cl元素的化合价降低被还原;故答案为:氯元素;(3)
 反应中O元素失电子,6个氧原子失电子12个电子,每个原子失去2个电子;
反应中O元素失电子,6个氧原子失电子12个电子,每个原子失去2个电子;故答案为:6个氧原子;一个氧原子失去2个电子;
(4)氯酸钾和二氧化锰混合物加热,氯酸钾分解生成氯化钾,则反应后固体混合物为二氧化锰和氯化钾,加水溶解,二氧化锰不溶于水,然后过滤、洗涤、干燥,得到二氧化锰固体;
故答案为:溶解、过滤、洗涤、干燥;
(5)MnO2+4HCl(浓)
| ||
| ||
故答案为:MnO2+4H++2Cl-
| ||
(6)氯酸钾和二氧化锰制取氧气时二氧化锰不参加反应,二氧化锰作催化剂,MnO2与浓盐酸反应生成氯气时二氧化锰中Mn元素的化合价降低,二氧化锰作氧化剂;
故答案为:催化剂;氧化剂;
(7)
 的反应中生成3mol氧气转移12mol电子,MnO2+4HCl(浓)
的反应中生成3mol氧气转移12mol电子,MnO2+4HCl(浓)
| ||
故答案为:1:2.
点评:本题考查了氧化还原反应、物质分离的基本操作、离子方程式的书写、电子转移数的计算等,题目难度中等,侧重于基础知识的综合应用的考查,注意把握氧化还原反应中化合价的变化的分析判断.

练习册系列答案
相关题目
钢铁发生电化学腐蚀时,负极发生的反应是( )
| A、2H++2e-═H2 |
| B、2H2O+O2+4e-═4OH- |
| C、Fe-2e-═Fe2+ |
| D、4OH-+4e-═2H2O+O2 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4LCCl4中含有的分子数目为NA |
| B、16.8g铁粉与足量水蒸气完全反应转移电子数为0.9NA |
| C、已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.当该反应放出184.8kJ热量时,形成N-H键数为12NA |
| D、1mol乙烯和丙烯的混合气体中α键数为5NA |
下列表示对应化学反应的离子方程式正确的是( )
| A、氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
| B、氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| C、NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、用稀硝酸除去试管内壁银:3Ag+4H++NO3-=3Ag++NO↑+2H2O |