题目内容
4.将1mol 乙酸(其羟基氧用 18O 标记)与乙醇在浓硫酸并加热条件下发生反应(不考虑副反应).下列叙述正确的是( )| A. | 浓硫酸只起到吸水作用,不参与反应 | |
| B. | 反应体系中含18O的分子有2种 | |
| C. | 乙酸乙酯中还有18O 原子 | |
| D. | 反应一段时间后乙醇中含有18O原子 |
分析 将1mol 乙酸(其羟基氧用 18O 标记)在浓硫酸存在条件下与足量乙醇充分反应,乙酸脱羟基,乙醇脱氢,化学方程式为:CH3CO18OH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H218O,以此解答该题.
解答 解:将1mol 乙酸(其羟基氧用 18O 标记)在浓硫酸存在条件下与足量乙醇充分反应,乙酸脱羟基,乙醇脱氢,化学方程式为:CH3CO18OH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H218O,
A.浓硫酸起到吸水、催化剂的作用,故A错误;
B.由方程式可知反应体系中CH3CO18OH、H218O存在18O,故B正确;
C.乙酸乙酯中不含18O 原子,故C错误;
D.乙醇中不含18O,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握酯化反应的特点,难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
15.下列叙述中不正确的是( )
| A. | 用石墨作电极电解CuSO4溶液,通电一段时间后,在标准状况下两极产生的气体可能相等 | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 电解池中的阳极和原电池中的负极上都发生还原反应 |
19.有机化合物M的结构简式为 ,关于M的说法正确的是( )
,关于M的说法正确的是( )
 ,关于M的说法正确的是( )
,关于M的说法正确的是( )| A. | 分子式为C10H12O3 | |
| B. | 1 molNa2CO3,最多能消耗l mol有机物M | |
| C. | 1 molM与足量金属钠反应生成11.2 L气体(标准状况) | |
| D. | M能发生取代反应、氧化反应和加成反应 |
9.某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究.
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定.在加热的条件下,它能分解生成氧气.研究表明,将新制的5%的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生.
(1)上述实验发生反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
(2)实验甲和实验乙的实验目的是探究反应物的不同浓度对反应速率的影响;实验丙、实验丁和实验戊的实验目的是探究在不同酸碱性条件下,催化剂对反应速率的影响.
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
①对实验戊,0~20s的反应速率v1=0.775mL/s,100~120s的反应速率v2=0.575mL/s.不考虑实验测量误差,二者速率存在差异的主要原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小.
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验丁(填“丙”、“丁”或“戊”).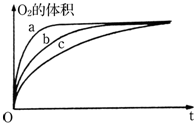
| 实验编号 | 反应物 | 催化剂 |
| 甲 | 试管中加入3mL 2%H2O2溶液和3滴蒸馏水 | 无 |
| 乙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 无 |
| 丙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 1mL 0.1mol/L FeCl3溶液 |
| 丁 | 试管中加入3mL 5%H2O2溶液和3滴稀盐酸溶液 | 1mL 0.1mol/L FeCl3溶液 |
| 戊 | 试管中加入3mL 5%H2O2溶液和3滴NaOH溶液 | 1mL 0.1mol/L FeCl3溶液 |
(1)上述实验发生反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
(2)实验甲和实验乙的实验目的是探究反应物的不同浓度对反应速率的影响;实验丙、实验丁和实验戊的实验目的是探究在不同酸碱性条件下,催化剂对反应速率的影响.
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
| 时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
| 气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
| 实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
| 实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验丁(填“丙”、“丁”或“戊”).

13.图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )


| A. | 能与NaOH发生反应,但不能与盐酸反应 | |
| B. | 能发生缩聚反应 | |
| C. | 能发生加成反应 | |
| D. | 能发生水解反应 |
10.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),说法正确的是( )


| A. | 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 加热时,②、③中的溶液为无色,冷却后又都变红 | |
| C. | ④中,浸泡在热水中的容器内气体颜色变浅,浸泡在冰水中的容器内气体颜色变深 | |
| D. | 四个“封管实验”中不是都有可逆反应发生 |

 .
.