题目内容
12.已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,A的相对分子量小于30,在如图变化中,中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,(反应条件未写出).
(1)写出下列各步变化的化学方程式(注明反应条件)
反应①CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;反应③2CH2CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;反应⑤n CH2=CH2$\stackrel{催化剂}{→}$
 .
.(2)写出下列反应类型:
反应①加成反应,反应③氧化反应.
分析 A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,A的相对分子量小于30,所以A是乙烯;
中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,能和新制氢氧化铜悬浊液产生砖红色沉淀说明C含有醛基,所以C是乙醛,则B是乙醇;
E有香味,说明E中含有酯基,羧酸和醇反应生成酯,所以D是乙酸;
F是高分子化合物,乙烯发生加聚反应生成聚乙烯,所以F是聚乙烯,以此解答该题.
解答 解:A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,A的相对分子量小于30,所以A是乙烯;
中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,能和新制氢氧化铜悬浊液产生砖红色沉淀说明C含有醛基,所以C是乙醛,则B是乙醇;
E有香味,说明E中含有酯基,羧酸和醇反应生成酯,所以D是乙酸;
F是高分子化合物,乙烯发生加聚反应生成聚乙烯,所以F是聚乙烯.
(1)乙烯和水在催化剂条件下发生加成反应生成乙醇,方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$ CH3CH2OH,
乙醛在催化条件下被氧化生成乙酸,方程式为2CH2CHO+O2 $\stackrel{催化剂}{→}$2CH3COOH,
在一定条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为:n CH2=CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$ CH3CH2OH;2CH2CHO+O2 $\stackrel{催化剂}{→}$2CH3COOH;n CH2=CH2$\stackrel{催化剂}{→}$ ;
;
(2)乙烯和水生成乙醇的反应是加成反应,乙醛发生氧化反应生成乙酸,故答案为:加成反应;氧化反应.
点评 本题考查了有机物的推断,为高频考点,侧重于学生的分析能力的考查,正确推断A是解本题关键,知道物质之间的转化和常见有机物的官能团及其性质,难度不大.

 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A. | 乙烯、环己烷 | B. | 甲烷苯 | C. | 乙炔苯 | D. | 乙烷乙醇 |
| A. | 超导金属 | B. | 形状记忆金属 | C. | 储氢金属 | D. | 光纤 |
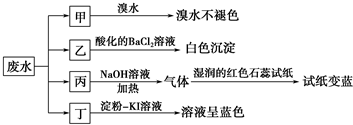
已知废水试样中可能含有下表中的离子:
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO32-、Y、NO3- |
(2)表中不能确定是否存在的阴离子是Cl-,能证明该阴离子是否存在的简单实验操作为取少量废水试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在.
(3)丁组实验在酸性条件下发生反应的离子方程式是6I-+2NO3-+8H+=2NO↑+3I2+4H2O.
| A. | 五种元素中B元素的金属性最强 | |
| B. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| C. | 元素C、D、E的最高价氧化物对应水化物的酸性递减 | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |

| A. | Ca(ClO)2 | B. | 氯水 | C. | NaOH | D. | 浓HCl |
| A. | 浓硫酸只起到吸水作用,不参与反应 | |
| B. | 反应体系中含18O的分子有2种 | |
| C. | 乙酸乙酯中还有18O 原子 | |
| D. | 反应一段时间后乙醇中含有18O原子 |
| A. | 在浓硫酸作催化剂时,可与硝酸发生反应 | |
| B. | 分子中含有三个C-C键和三个C=C键 | |
| C. | 分子中C、H元素的质量比为6:1 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
| A. | CH3OH | B. |  | C. |  | D. |  |