题目内容
10.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),说法正确的是( )
| A. | 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 加热时,②、③中的溶液为无色,冷却后又都变红 | |
| C. | ④中,浸泡在热水中的容器内气体颜色变浅,浸泡在冰水中的容器内气体颜色变深 | |
| D. | 四个“封管实验”中不是都有可逆反应发生 |
分析 A.碘单质易升华,属于碘单质的物理性质,不能据此判断碘的热稳定性;
B.氨气使酚酞溶液变红,二氧化硫能够使品红溶液褪色;
C.二氧化氮转化成四氧化二氮的反应为放热反应,升高温度平衡向着逆向移动;
D.可逆反应,须在同等条件下,既能向正反应进行,又能向逆反应进行.
解答 解:A.加热时,①上部汇集了固体碘单质,说明碘发生了升华现象,为其物理性质,不能说明碘单质的热稳定性较差,故A错误;
B.②中氨水显碱性,使酚酞变红,加热时,氨气逸出,冷却后,氨气又和水反应,变成红色,二氧化硫与品红显无色,加热后二氧化硫逸出,显红色,二者现象不同,故B错误;
C.2NO2(g)?N2O4(g)△H=-92.4kJ/mol,正反应为放热反应,升高温度平衡向逆反应方向移动,则颜色变深,④中浸泡在热水中的容器内气体颜色变深,反之变浅,所以浸泡在冰水中的容器内气体颜色变浅,故C错误;
D.①中碘的升华为物理变化;②中一水合氨的电离为可逆反应;③中亚硫酸的电离为可逆过程,④中二氧化氮与四氧化二氮的转化为可逆反应,所以四个“封管实验”中不是都有可逆反应发生,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及可逆反应、漂白性、平衡移动的因素、碘单质的性质等知识,注重基础知识的考查和实验原理,题目难度不大.

练习册系列答案
相关题目
4.将1mol 乙酸(其羟基氧用 18O 标记)与乙醇在浓硫酸并加热条件下发生反应(不考虑副反应).下列叙述正确的是( )
| A. | 浓硫酸只起到吸水作用,不参与反应 | |
| B. | 反应体系中含18O的分子有2种 | |
| C. | 乙酸乙酯中还有18O 原子 | |
| D. | 反应一段时间后乙醇中含有18O原子 |
2.下列有机物中能发生消去反应的是( )
| A. | CH3OH | B. |  | C. |  | D. |  |
15.如图是铝热反应的实验装置,有关该反应的下列说法中不正确的是( )
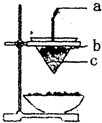
①a为铝条②b为氧化铁与铝粉的混合物
③2mol氧化剂参与反应则电子转移6NA个④还原剂与氧化产物的物质的量之比为1:2.

①a为铝条②b为氧化铁与铝粉的混合物
③2mol氧化剂参与反应则电子转移6NA个④还原剂与氧化产物的物质的量之比为1:2.
| A. | ①②④ | B. | ①②③ | C. | ②③ | D. | 全部 |
19.工业上冶炼金属一般用热分解法、热还原法和电解法.采用的不同的冶炼方法.你认为选择的原则主要是依据( )
| A. | 金属熔点的高低 | B. | 金属阳离子得电子的能力 | ||
| C. | 金属在自然界的存在形式 | D. | 金属元素在地壳中的含量 |
20.下列离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7,Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
