题目内容
14.某有机物中只含C、H、O三种元素,相对分子质量为46,2.3g该物质完全燃烧后生成0.1mol二氧化碳和2.7g水,该化合物的分子式为C2H6O.分析 根据n=$\frac{m}{M}$计算出水的物质的量,再根据质量守恒计算出2.3g该有机物中含有的C、H元素的物质的量、质量及氧元素的质量、物质的量,再根据n(C):n(H):n(O)计算出该有机物的实验式,结合相对分子量确定其分子式.
解答 解:2.3g该有机物完全燃烧产物为H2O和CO2,2.7g水的物质的量为:n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则n(H)=0.15mol×2=0.3mol,m(H)=1g/mol×0.3mol=0.3g;
二氧化碳的物质的量为:n(CO2)=0.1mol,则n(C)=0.1mol,m(C)=12g/mol×0.1mol=1.2g,
该有机物中氧元素的质量为:m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,
该有机物分子中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,
该物质的实验式为C2H6O,设其分子式为 (C2H6O)n,有机物相对分子质量为46,则n=$\frac{46}{46}$=1,
则有机物的分子式为:C2H6O.
故答案为:C2H6O.
点评 本题考查了有机物分子式、结构简式的确定,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握常见有机物的分子式的计算方法,能够正确书写常见有机物的结构简式,注意质量守恒定律在计算中的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2. 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A. | 乙烯、环己烷 | B. | 甲烷苯 | C. | 乙炔苯 | D. | 乙烷乙醇 |
19.元素周期表中某区域的一些元素用于制造催化剂和耐高温、耐腐蚀的合金材料,他们是( )
| A. | 右上方区域的非金属元素 | |
| B. | 过渡区域的金属元素 | |
| C. | 金属元素和非金属元素分界线附近的元素 | |
| D. | 稀有气体元素 |
6.下列物质转化需要加入氧化剂才能实现的是( )
| A. | H2O2→O2 | B. | SO2→SO32- | C. | Cl2→HCl | D. | HNO3→NO2 |
3.有一种合金当环境温度远小于其转变温度时,可以随便改变它的形状,当达到转变温度时,会恢复其原来面貌,具有这种效应的合金为( )
| A. | 超导金属 | B. | 形状记忆金属 | C. | 储氢金属 | D. | 光纤 |
4.将1mol 乙酸(其羟基氧用 18O 标记)与乙醇在浓硫酸并加热条件下发生反应(不考虑副反应).下列叙述正确的是( )
| A. | 浓硫酸只起到吸水作用,不参与反应 | |
| B. | 反应体系中含18O的分子有2种 | |
| C. | 乙酸乙酯中还有18O 原子 | |
| D. | 反应一段时间后乙醇中含有18O原子 |
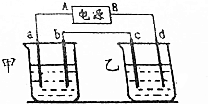 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
 图为电解氯化铜溶液的装置
图为电解氯化铜溶液的装置