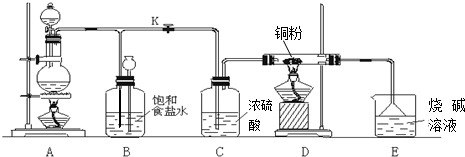
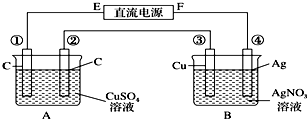
题目内容
11.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,用ClO2替代Cl2对自来水进行消毒是城市饮用水处理新技术.工业上制备ClO2的方法很多,可以用合适的还原剂还原NaClO3制得.(1)在硫酸酸化的条件下用 草酸还原NaClO3制ClO2,其反应的化学方程式为2NaClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+Na2SO4+2H2O.
(2)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O.
①写出第二步反应的离子方程式CH3OH+3Cl2+H2O=CO2↑+6Cl-+6H+.
②工业生产时需在反应物中加少量Cl-,其作用是催化作用.
(3)ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,写出ClO2与NaOH溶液反应的离子方程式2ClO2+2OH-=ClO2-+ClO3-+H2O.
(4)ClO2可用于含CN-废水的处理,产生的两种气体可以直接排入空气.
①已知CN-中C、N的最外层都满足8电子结构,写出CN-的电子式
 .
.②写出该反应的离子方程式2CN-+2ClO2=2CO2↑+N2↑+2Cl-.
分析 (1)在硫酸酸化的条件下用 草酸还原NaClO3制ClO2,结合反应物、生成物以及质量守恒书写化学方程式;
(2)①CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,则该反应方程式为
CH3OH+6ClO3-+6H+=6ClO2↑+CO2↑+5H2O,将总方程式减去第一步反应方程式即得第二步反应方程式;
②氯离子在第一步作反应物、在第二步作生成物;
(3)ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐ClO2与NaOH溶液反应生成ClO2-、ClO3-;
(4)ClO2可用于含CN-废水的处理,产生的两种气体可以直接排入空气,应生成二氧化碳和氮气.
解答 解:(1)在硫酸酸化的条件下用 草酸还原NaClO3制ClO2,反应的化学方程式为2NaClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+Na2SO4+2H2O,
故答案为:2NaClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+Na2SO4+2H2O;
(2)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=CO2↑+6Cl-+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化作用;
(3)ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐ClO2与NaOH溶液反应生成ClO2-、ClO3-,反应的离子方程式为2ClO2+2OH-=ClO2-+ClO3-+H2O,
故答案为:2ClO2+2OH-=ClO2-+ClO3-+H2O;
(4)①CN-与氮气为等电子体,含有三键,电子式为 ,故答案为:
,故答案为: ;
;
②ClO2可用于含CN-废水的处理,产生的两种气体可以直接排入空气,应生成二氧化碳和氮气,反应的离子方程式为2CN-+2ClO2=2CO2↑+N2↑+2Cl-,
故答案为:2CN-+2ClO2=2CO2↑+N2↑+2Cl-.
点评 本题综合考查含氯化合物知识,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握相关基础知识的积累,难度不大.

| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铁棒插入浓硝酸中,无明显现象 | 铁与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 原溶液中可能含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
Ⅰ.①取反应后溶液少许于试管中,滴入几滴酚酞试液,溶液变红.
甲同学认为一定是剩余氢氧化钠使溶液显碱性.
乙同学不同意他的看法,理由是:CO32-+H2O?HCO3-+OH-(或HCO3-+H2O?H2CO3+OH-)(用离子方程式表示).
丙同学为了验证甲乙两位同学的观点,设计了如下实验:取少量一定浓度的NaOH溶液并向溶液中通入过量CO2,再向反应后的溶液中滴入酚酞,溶液仍然变红.(不考虑CO2溶解),请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
②若反应后的溶液中只有一种酸式盐,请设计实验证明该结论.
提供试剂:稀盐酸,Ba(OH)2溶液,BaCl2溶液,酚酞,澄清石灰水,MgCl2溶液,NaOH溶液
| 实验步骤 | 预期现象和结论 |
请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH- ).
| A. | 碘-131的中子数为78 | B. | 碘-131的质量数为53 | ||
| C. | 碘与铯互称同位素 | D. | 铯-137的质子数为137 |
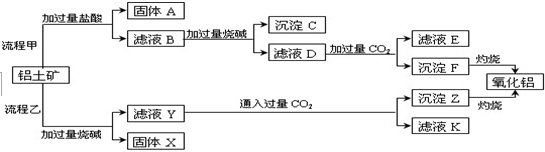
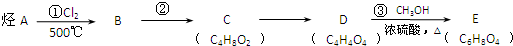
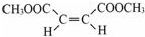 .
.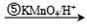 $\stackrel{⑥}{→}$$\stackrel{⑦酸化}{→}$D.则⑥所需的无机试剂及反应条件是NaOH的醇溶液、加热;④的化学方程式是
$\stackrel{⑥}{→}$$\stackrel{⑦酸化}{→}$D.则⑥所需的无机试剂及反应条件是NaOH的醇溶液、加热;④的化学方程式是 .
.