题目内容
1.如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.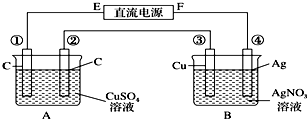
(1)电源F为正极;第②极为阳极;A池为电解池.
(2)A池中第②极上的电极反应式为4OH--4e-=2H2O+O2↑.
(3)通电前A池中原混合溶液Cu2+的浓度为0.05mol•L-1.
分析 (1)通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,第②极是阳极,根据A装置是通电电解硫酸铜溶液的装置;
(2)第②极是阳极,阳极上氢氧根离子放电生成氧气,据此写出电极反应式;
(3)根据阴阳极上转移电子守恒计算铜转移的电子,再根据铜和转移电子之间的关系式计算硫酸铜的物质的量浓度.
解答 解:(1)通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,第②极是阳极,B装置中,银作阳极,电解质溶液是硝酸银,阳极材料和电解质溶液具有相同的金属元素,所以是电镀池,A装置碳电极上①是铜离子得到电子发生还原反应生成铜,②电解时氢氧根离子失电子发生氧化反应生成氧气,为电解池,
故答案为:正;阳;电解;
(2)第②极是阳极,A中阳极上氢氧根离子放电生成氧气,其电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)通电5min后,第③极增重2.16g为银,物质的量n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,Ag++e-=Ag.电子转移0.02mol
A池中第②极上的电极反应式:4OH--4e-═2H2O+O2↑,①电极反应:Cu2++2e-=Cu,
转移0.02mol电子,所以Cu2+的物质的量为0.01mol,通电前c(CuSO4)=$\frac{0.01mol}{0.2L}$=0.05 mol•L-1,
故答案为:0.05 mol•L-1.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA | |
| B. | 78克Na2O2含有阴离子数为2NA | |
| C. | 常温下,在18g 18O2中含有氧原子数为NA | |
| D. | 1mol-OH所含的电子数目为7NA |
9.有机物分子中原子间 (或原子与原子团间) 的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 苯酚能跟 NaOH 溶液反应,乙醇不能与 NaOH 溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
16.下列粒子共存的说法正确或离子方程式表达符合要求的是( )
| A. | 加入铝粉有氢气生成的溶液中可能大量存在:Ba2+、AlO2-、Cl- | |
| B. | 在含有NH3•H2O的溶液中可能大量共存的离子:Fe3+、HCO3-、NO3- | |
| C. | 亚硫酸的电离:H2SO3═HSO3-+H+ | |
| D. | 向NaHSO4溶液中加入Ba(OH)2溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
6.下列说法或表示方法正确的是( )
| A. | 丙烷分子的比例模型: | B. | 聚丙烯的结构简式: | ||
| C. | 乙酸的实验式为:CH2O | D. | 化学名词:乙酸乙脂、苯、钳锅 |
13.下列叙述中与盐类的水解有关的是
①纯碱溶液去油污;②铁在潮湿的环境下生锈;③NH4Cl与ZnCl2溶液可作焊接中的除锈剂;④盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞;⑤酸雨在空气中放置一段时间pH降低;⑥草木灰与铵态氮肥不能混合施用( )
①纯碱溶液去油污;②铁在潮湿的环境下生锈;③NH4Cl与ZnCl2溶液可作焊接中的除锈剂;④盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞;⑤酸雨在空气中放置一段时间pH降低;⑥草木灰与铵态氮肥不能混合施用( )
| A. | ①③④⑥ | B. | ①②⑤⑥ | C. | ①③④⑤ | D. | 全有关 |
11.为检验下列物质置于空气中是否已变质,所选试剂(括号内物质)不能达到目的是( )
| A. | FeCl2溶液(KSCN) | B. | KOH(盐酸) | ||
| C. | Na2SO3溶液(BaCl2) | D. | HCHO溶液(石蕊试液) |
 .
.