题目内容
11.已知,E能发生银镜反应.根据下列框图:
回答下列问题:
(1)F分子中含有的官能团的名称是:羧基、羟基.
(2)由F转化成H的反应类型属于酯化反应.
(3)下列关于有机物A的叙述正确的是BC.
A.分子式为C10H14O3 B.能发生氧化、消去等反应
C.能与H2发生加成反应 D.能与NaHCO3溶液反应放出CO2
(4)写出B+D→E的化学方程式:CH3OH+HCOOH$?_{△}^{浓硫酸}$HCOOCH3+H2O.
分析 由H的结构简式可知F为 ,F发生催化氧化得到G为
,F发生催化氧化得到G为 .B连续氧化得到D,则B为醇、C为醛、D为羧酸,B与D反应生成E为酯,而E可以发生银镜反应,则E为甲酸酯,故B为CH3OH、C为HCHO、D为HCOOH、E为HCOOCH3,A发生水解反应得到B与F,则A为
.B连续氧化得到D,则B为醇、C为醛、D为羧酸,B与D反应生成E为酯,而E可以发生银镜反应,则E为甲酸酯,故B为CH3OH、C为HCHO、D为HCOOH、E为HCOOCH3,A发生水解反应得到B与F,则A为 ,据此解答.
,据此解答.
解答 解:由H的结构简式可知F为 ,F发生催化氧化得到G为
,F发生催化氧化得到G为 .B连续氧化得到D,则B为醇、C为醛、D为羧酸,B与D反应生成E为酯,而E可以发生银镜反应,则E为甲酸酯,故B为CH3OH、C为HCHO、D为HCOOH、E为HCOOCH3,A发生水解反应得到B与F,则A为
.B连续氧化得到D,则B为醇、C为醛、D为羧酸,B与D反应生成E为酯,而E可以发生银镜反应,则E为甲酸酯,故B为CH3OH、C为HCHO、D为HCOOH、E为HCOOCH3,A发生水解反应得到B与F,则A为 .
.
(1)F为 ,分子中含有的官能团的名称是:羧基、羟基,
,分子中含有的官能团的名称是:羧基、羟基,
故答案为:羧基、羟基;
(2)由F转化成H的反应类型属于酯化反应,
故答案为:酯化反应;
(3)有机物A为 ,
,
A.有机物A的分子式为C10H12O3,故A错误;
B.含有醇羟基,且羟基连接的碳原子含有H原子,可以发生氧化反应,与羟基相连的碳原子相邻碳原子上含有H原子,可以发生消去反应,故B正确;
C.含有苯环,能与H2发生加成反应,故C正确;
D.不含羧基,不能与NaHCO3溶液反应放出CO2,故D错误,
故选:BC;
(4)B+D→E的化学方程式:CH3OH+HCOOH$?_{△}^{浓硫酸}$HCOOCH3+H2O,
故答案为:CH3OH+HCOOH$?_{△}^{浓硫酸}$HCOOCH3+H2O.
点评 本题考查有机物的推断,根据H的结构逆推可知F,结合B转化得到E且E可以发生银镜反应推断,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.有一根粗铝含铁和硅两种杂质,取等质量的粗铝分别投入足量稀HCl和足量的NaOH液中,放出等量的H2,则该粗铝中,铁和硅的关系为( )
a.物质的量之比为2:1;b.物质的量之比为3:1; c.质量之比为2:1;d.质量之比为4:1.
a.物质的量之比为2:1;b.物质的量之比为3:1; c.质量之比为2:1;d.质量之比为4:1.
| A. | bd | B. | bc | C. | ad | D. | 只有d |
2.某校化学小组学生利用下图所示装置进行“乙二酸(结构简式为HOOC-COOH,俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
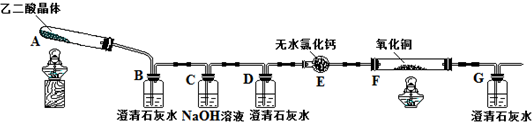
(1)证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
(2)证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜完全变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法、现象、结论(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配制好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式:c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
(2)证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜完全变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法、现象、结论(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配制好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
16.将铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)
由上述数据推测:
(1)硝酸的物质的量浓度;
(2)③中溶解金属的成分是什么?其相应的质量为多少克?
| 编号 | ① | ② | ③ |
| 稀硝酸体积/mL | 100 | 200 | 300 |
| 剩余金属/g | 30.4 | 22 | 12.8 |
| NO体积/mL | 2240 | 4480 | 6720 |
(1)硝酸的物质的量浓度;
(2)③中溶解金属的成分是什么?其相应的质量为多少克?
3.某温度下,反应2A(g)?B(g)-Q 在密闭容器中达到平衡,平衡后c(A):c(B)=a,若改变某一条件,足够时间后反应达到平衡状态,此时c(A):c(B)=b,下列叙述正确的是( )
| A. | 若保持温度,保持容器容积固定不变,向容器内补充B气体,则有a<b | |
| B. | 若保持温度、压强不变,充入惰性气体,则有a>b | |
| C. | 若其他条件不变,升高温度,则有a<b | |
| D. | 若a=b,则可能是在该温度下,保持容器容积固定不变情况下充入了惰性气体 |
20.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
1.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方案Ⅱ:铜铝混合物$→_{充分反应}^{足量溶液B}$测定剩余固体的质量
下列有关判断中不正确的是( )
方案Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方案Ⅱ:铜铝混合物$→_{充分反应}^{足量溶液B}$测定剩余固体的质量
下列有关判断中不正确的是( )
| A. | 溶液A和B均可以是稀硫酸或NaOH溶液 | |
| B. | 若溶液B选用浓硝酸,则测得铜的质量分数偏大 | |
| C. | 溶液A和B均不可选用浓硝酸 | |
| D. | 实验室中方案Ⅱ更便于实施 |
