题目内容
6.某研究性学习小组的同学查阅资料获得如下信息:①NH3可与CuO反应,产物之一是N2;②氮化镁易与水反应生成Mg(OH)2与NH3.他们设计了如图所示的装置验证上述信息.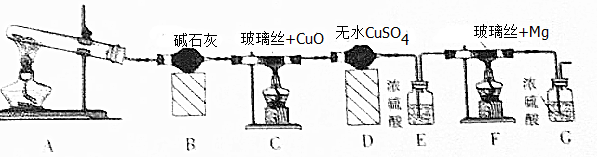
(1)检查本套装置气密性的方法是连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好,试管中的试剂通常是氯化铵和氢氧化钙固体,装置E的作用是吸收水蒸气,干燥气体.
(2)本套装置有三处需要加热,实验中应放在最后加热的是F,这样操作的目的是防止装置F中空气未排净,镁和空气中的氧气、氮气、二氧化碳发生反应,氮化镁和水也反应,制得氮化镁不纯,证明C中反应有水生成的现象是装置D中无水硫酸铜白色变化为蓝色,若没有装置G,则可能产生的问题是氮化镁易与水反应生成Mg(OH)2与NH3.
(3)C中反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
分析 装置A是利用氯化铵和氢氧化钙加热反应制备氨气,装置B为干燥氨气,氨气通入装置C和氧化铜加热反应,NH3可与CuO反应,产物之一是N2,通过装置D中的无水硫酸铜检验生成产物中的水蒸气,通过装置E中的浓硫酸吸收水蒸气,通过装置F和镁反应,氮化镁易与水反应生成Mg(OH)2与NH3.装置G是防止空气中的水蒸气进入装置F,
(1)连接装置后A处加热EG中导气管有气泡冒出,停止加热导气管中有一段水柱上升证明气密性,实验室中是利用氯化铵和氢氧化钙固体加热制备氨气,浓硫酸具有吸水性;
(2)氮化镁易与水反应生成Mg(OH)2与NH3.若未排净装置F中的空气,镁会和空气中氧气、氮气、二氧化碳等发生反应,无水硫酸铜为白色固体遇到水蒸气变化为蓝色,若没有装置G,则可能产生的问题是氮化镁易与水反应生成Mg(OH)2与NH3;
(3)装置C中氨气与灼热氧化铜反应可以生成两种单质,应是氨气还原氧化铜为铜,氨气被还原为氮气,依据原子守恒配平书写化学方程式;
解答 解:(1)检查本套装置气密性的方法是:连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好,实验室中是利用氯化铵和氢氧化钙固体在大试管中加热反应制备氨气,浓硫酸具有吸水性,装置E的作用是吸收水蒸气,干燥气体,
故答案为:连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好; 氯化铵和氢氧化钙固体;吸收水蒸气,干燥气体;
(2)若未排净装置F中的空气,镁会和空气中氧气、氮气、二氧化碳等发生反应,氮化镁易与水也反应生成Mg(OH)2与NH3.制备得到氮化镁不纯,所以装置有三处需要加热,先加热A生成氨气充满装置后,再加热装置C,最后加热装置F,实验中应放在最后加热的是F,无水硫酸铜为白色固体遇到水蒸气变化为蓝色,证明C中反应有水生成的现象是装置D中无水硫酸铜白色变化为蓝色,装置G是防止空气中的水蒸气进入装置F,若没有装置G,则可能产生的问题是氮化镁易与水反应生成Mg(OH)2与NH3;
故答案为:F;防止装置F中空气未排净,镁和空气中的氧气、氮气、二氧化碳发生反应,氮化镁和水也反应,制得氮化镁不纯;装置D中无水硫酸铜白色变化为蓝色;氮化镁易与水反应生成Mg(OH)2与NH3;
(3)装置C中氨气与灼热氧化铜反应可以生成两种单质,反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O.
点评 本题考查了物质性质的实验验证、氨气制备、性质验证、反应现象、产物检验等知识点,掌握基础是解题关键,题目难度中等.

 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.7×10-7,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.
(3)已知反应2HI(g)?H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299 kJ.
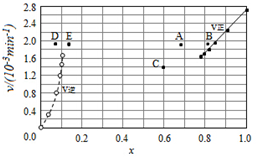
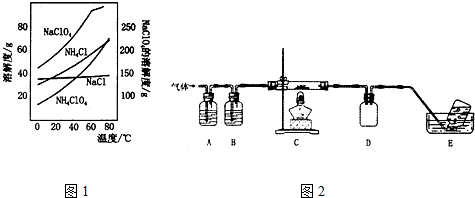
(4)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).
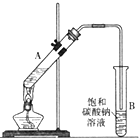 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
C2H5OH+C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$\stackrel{△}{→}$CH3COOCH2CH3+H2O.
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
①NO(g)+Br2(g)?NOBr2(g) 快
②NO(g)+NOBr2(g)?2NOBr(g) 慢
下列有关该反应的说法正确的是( )
| A. | 该反应的速率主要取决于①的快慢 | |
| B. | NOBr2是该反应的催化剂 | |
| C. | 正反应的活化能比逆反应的活化能小a kJ•mol-1 | |
| D. | 增大Br2(g)浓度能增大活化分子百分数,加快反应速率 |
 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是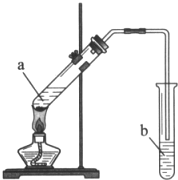 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.
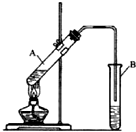 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.