题目内容
下列电离方程式正确的是( )
| A、CuCl2═Cu2++Cl2- |
| B、Al2(SO4)3=2Al3++3SO42- |
| C、Fe2(SO4)3═2Fe2++3SO42- |
| D、Ba(NO3)2═Ba2++2(NO3)2- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:强电解质完全电离,用等号,弱电解质部分电离用可逆号,原子团不能拆,注意离子符号的正确书写.
解答:
解:A.氯化铜为强电解质,完全电离,电离方程式:CuCl2═Cu2++2Cl-,故A错误;
B.硫酸铝为强电解质,完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,故B正确;
C.硫酸铁为强电解质,完全电离,电离方程式为:Fe2(SO4)3═2Fe3++3SO42-,故C错误;
D.硝酸钡为强电解质,完全电离,电离方程式为:Ba(NO3)2═Ba2++2NO3-,故D错误;
故选B.
B.硫酸铝为强电解质,完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,故B正确;
C.硫酸铁为强电解质,完全电离,电离方程式为:Fe2(SO4)3═2Fe3++3SO42-,故C错误;
D.硝酸钡为强电解质,完全电离,电离方程式为:Ba(NO3)2═Ba2++2NO3-,故D错误;
故选B.
点评:本题考查了电解质电离方程式的书写,题目难度不大,明确电解质的强弱及电离方式是解题关键,注意离子符合的正确书写.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
关于如图所示的原电池,下列说法正确的是( )
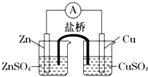

| A、锌是电池的负极,发生还原反应 |
| B、盐桥中的阳离子向硫酸铜溶液中迁移 |
| C、电流从锌电极通过检流计流向铜电极 |
| D、铜电极上发生的电极反应是2H++e-=H2↑ |
把V L含有KCl和BaCl2的混合溶液分成两等份,一份加入含a mol AgNO3的溶液,恰好使Cl-完全沉淀为AgCl;另一份加入含b mol Na2SO4的溶液,恰好使Ba2+完全沉淀为BaSO4.则原混合溶液中钾离子的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-═4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2═2H2O |
| D、用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
下列基本反应类型中,一定是氧化还原反应的是( )
| A、复分解反应 | B、置换反应 |
| C、分解反应 | D、化合反应 |
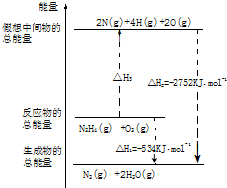 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.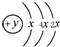 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空: