题目内容
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、化合物YZ4比化合物XZ熔点高 |
| B、W与X,W与Z均能形成某种具有漂白性的化合物,但原理不同 |
| C、化合物X2YW3既含离子键,又含共价键,可做粘胶剂和防火剂 |
| D、Y的氧化物与Z的氢化物、X的最高价氧化物对应的水化物的溶液均能反应 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;Y的原子半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是Si元素;Z的非金属性在同周期元素中最强,原子序数大于Si,故Z为Cl元素,据此解答.
解答:
解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;Y的原子半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是Si元素;Z的非金属性在同周期元素中最强,原子序数大于Si,故Z为Cl元素,
A.化合物SiCl4属于分子晶体,化合物NaCl属于离子晶体,NaCl的熔点更高,故A错误;
B.W与X形成的过氧化钠具有漂白性,W与Z均能形成ClO2等具有漂白性,均是利用强氧化性,氧化有色物质为无色,漂白原理相同,故B错误;
C.化合物Na2SiO3既含离子键,又含共价键,可做粘胶剂和防火剂,故C正确;
D.Y的氧化物为二氧化硅,Z的氢化物为HCl,X高价氧化物对应的水化物为NaOH,二氧化硅能与氢氧化钠溶液反应,不能与盐酸反应,故D错误,
故选C.
A.化合物SiCl4属于分子晶体,化合物NaCl属于离子晶体,NaCl的熔点更高,故A错误;
B.W与X形成的过氧化钠具有漂白性,W与Z均能形成ClO2等具有漂白性,均是利用强氧化性,氧化有色物质为无色,漂白原理相同,故B错误;
C.化合物Na2SiO3既含离子键,又含共价键,可做粘胶剂和防火剂,故C正确;
D.Y的氧化物为二氧化硅,Z的氢化物为HCl,X高价氧化物对应的水化物为NaOH,二氧化硅能与氢氧化钠溶液反应,不能与盐酸反应,故D错误,
故选C.
点评:本题考查结构性质位置关系应用,关键是根据原子半径与原子序数确定元素,注意对基础知识的理解掌握.

练习册系列答案
相关题目
关于如图所示的原电池,下列说法正确的是( )
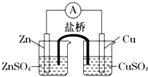

| A、锌是电池的负极,发生还原反应 |
| B、盐桥中的阳离子向硫酸铜溶液中迁移 |
| C、电流从锌电极通过检流计流向铜电极 |
| D、铜电极上发生的电极反应是2H++e-=H2↑ |
下列离子反应方程书写正确的是( )
| A、H2O+H2O?H3O++OH- |
| B、CO32-+2H2O?H2CO3+2OH- |
| C、Ca(OH)2+2H+?Ca2++2H2O |
| D、Al3++3H2O═Al(OH)3↓+3H+ |
将钠、镁、铝各0.3mol,分别放入100mL 1mol?L-1的硫酸中,同温同压下产生的气体的体积比是( )
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:2 |
| D、3:1:1 |
把V L含有KCl和BaCl2的混合溶液分成两等份,一份加入含a mol AgNO3的溶液,恰好使Cl-完全沉淀为AgCl;另一份加入含b mol Na2SO4的溶液,恰好使Ba2+完全沉淀为BaSO4.则原混合溶液中钾离子的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题:
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题: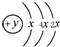 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空: