题目内容
能源问题一直是制约经济发展的重要因素,我国目前使用的能源主要是传统的三大化石燃料.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧热的热化学方程式是 .
(2)将煤转化为清洁气体燃料:已知:H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol,C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol,写出焦炭与水蒸气反应制H2和CO的热化学方程式 .
(3)请写出CH4燃料电池以KOH溶液为电解液的负极电极反应式 .
(4)汽车尾气的主要成分为氮的氧化物.已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变 C.2v正(N2)=v逆(NO)
D.N2的体积分数不再改变 E.混合气体的密度不再改变
(5)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)?CO2(g)+H2(g).在420℃时,平衡常数K=9.若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 .
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧热的热化学方程式是
(2)将煤转化为清洁气体燃料:已知:H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
(3)请写出CH4燃料电池以KOH溶液为电解液的负极电极反应式
(4)汽车尾气的主要成分为氮的氧化物.已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变 C.2v正(N2)=v逆(NO)
D.N2的体积分数不再改变 E.混合气体的密度不再改变
(5)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)?CO2(g)+H2(g).在420℃时,平衡常数K=9.若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
考点:热化学方程式,化学电源新型电池,化学平衡状态的判断,化学平衡的计算
专题:基本概念与基本理论
分析:(1)根据8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,结合燃烧热的定义计算求出1molCH4完全燃烧放出的热量,然后写出热化学方程式;
(2)利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
(3)甲烷燃料电池中,负极上是甲烷发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳;
(4)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
(4)依据化学平衡的三段式列式计算,平衡状态下的物质转化率=
×100%,运用平衡常数的概念列式得到.
(2)利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
(3)甲烷燃料电池中,负极上是甲烷发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳;
(4)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
(4)依据化学平衡的三段式列式计算,平衡状态下的物质转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则16g即1molCH4完全燃烧生成液态水时放出的热量是890.3kJ的热量,热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ?mol;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ?mol;
(2)H2(g)+
O2(g)=H20 (g)△H=-241.8kJ?mol-1 ①
C(s)+
O2(g)=CO (g)△H=-110.5kJ?mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
(3)甲烷燃料电池以KOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O;
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(4)A、该反应是反应气体体积不变的反应,所以无论反应是否达到平衡状态,体系的压强始终不变,故A错误;
B、混合气体的平均相对分子质量不再改变,说明总物质的量不变,正逆反应速率相等,故B正确;
C、2v正(N2)=v逆(NO)即正逆反应速率之比等于系数之比(不同物质),反应到达平衡,故C正确;
D.N2的体积分数不再改变,说明反应到达平衡,故D正确;
E.混合气体的质量不变,容器的体积不变,所以无论反应是否达到平衡状态,混合气体的密度都不再改变,故E错误;
故选BCD.
(5)设一氧化碳的消耗浓度为X,分析三段式列式计算:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) X X X X
平衡量(mol/L)0.1-X 0.1-X X X
平衡常数K=
=
=9
解得:X=0.075mol/L,则一氧化碳转化率=
×100%=75%;
故答案为:75%.
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ?mol;
(2)H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
(3)甲烷燃料电池以KOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O;
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(4)A、该反应是反应气体体积不变的反应,所以无论反应是否达到平衡状态,体系的压强始终不变,故A错误;
B、混合气体的平均相对分子质量不再改变,说明总物质的量不变,正逆反应速率相等,故B正确;
C、2v正(N2)=v逆(NO)即正逆反应速率之比等于系数之比(不同物质),反应到达平衡,故C正确;
D.N2的体积分数不再改变,说明反应到达平衡,故D正确;
E.混合气体的质量不变,容器的体积不变,所以无论反应是否达到平衡状态,混合气体的密度都不再改变,故E错误;
故选BCD.
(5)设一氧化碳的消耗浓度为X,分析三段式列式计算:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) X X X X
平衡量(mol/L)0.1-X 0.1-X X X
平衡常数K=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| X2 |
| (0.1-X)2 |
解得:X=0.075mol/L,则一氧化碳转化率=
| 0.075 |
| 0.1 |
故答案为:75%.
点评:本题考查了热化学方程式的书写、电极反应的书写、盖斯定律的应用、化学平衡的三段式计算,平衡常数、转化率的概念计算应用,注意平衡状态的判断是关键,难度中等.

练习册系列答案
相关题目
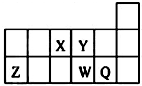 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、Z的氧化物能与水反应 |
| C、离子Y2-和Z3+的核外电子数和电子层数都相同 |
| D、元素Y的氢化物的稳定性比W的氢化物强 |
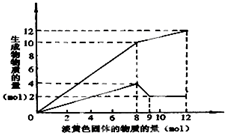 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
