题目内容
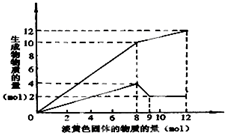 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:(1)在该溶液中含有的离子是
(2)所加的淡黄色固体是
考点:离子方程式的有关计算
专题:计算题
分析:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为2mol,氢氧化铝为4mol-2mol=2mol,根据元素守恒计算Al3+、Mg2+物质的量,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,计算加入8mol过氧化钠生成氧气的物质的量,再计算氨气物质的量,进而计算n(NH4+).
解答:
解:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,
(1)由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol.
当n(Na2O2)=8mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=8mol×
=4mol,所以n(NH4+)=n(NH3)=10mol-n(O2)=6mol,
故n(Mg2+):n(Al3+):n(NH4+)=2mol:2mol:6mol=1:1:3,
故答案为:NH4+、Al3+、Mg2+;n(Mg2+):n(Al3+):n(NH4+)=1:1:3;
(2)由上述分析可知,淡黄色固体为:Na2O2,故答案为:Na2O2.
(1)由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol.
当n(Na2O2)=8mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=8mol×
| 1 |
| 2 |
故n(Mg2+):n(Al3+):n(NH4+)=2mol:2mol:6mol=1:1:3,
故答案为:NH4+、Al3+、Mg2+;n(Mg2+):n(Al3+):n(NH4+)=1:1:3;
(2)由上述分析可知,淡黄色固体为:Na2O2,故答案为:Na2O2.
点评:本题考查无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会生成氨气逸出.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
2008年诺贝尔化学奖得主钱永健16岁时就以研究金属与硫氰化合物结合而获得“西屋科学天才奖”.根据所学知识,下列离子在溶液中易与SCN -结合的是( )
| A、K+ |
| B、NH4+ |
| C、Na+ |
| D、Fe3+ |
下列说法中正确的是( )
| A、摩尔是国际单位制中的七个物理量之一 |
| B、摩尔是物质的量的单位,简称摩,符号为mol |
| C、氧气的摩尔质量为32g |
| D、每摩尔任何物质均含有6.02×1023个原子 |
下列各组离子在指定溶液中一定能大量共存的是( )
| A、水电离的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、Cl-、NO3- |
| B、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C、在酸性条件下:Fe2+、Cl-、NO3-、K+ |
| D、在无色溶液中:Al3+、Cl-、K+、AlO2- |
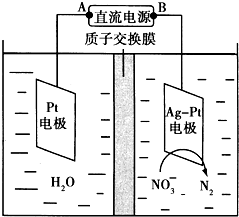 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.