题目内容
写出下列物质的电离方程式
(1)碳酸氢钠
(2)硝酸镁
(3)一水合氨 .
(1)碳酸氢钠
(2)硝酸镁
(3)一水合氨
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,据此进行分析解答.
(1)碳酸是弱酸,电离方程式中,碳酸氢根离子不能拆,碳酸氢钠在水中电离出钠离子和碳酸氢根离子;
(2)硝酸钙为强电解质,完全电离时生成钙离子、硝酸根离子;
(3)一水合氨是弱碱,不能完全电离.
(1)碳酸是弱酸,电离方程式中,碳酸氢根离子不能拆,碳酸氢钠在水中电离出钠离子和碳酸氢根离子;
(2)硝酸钙为强电解质,完全电离时生成钙离子、硝酸根离子;
(3)一水合氨是弱碱,不能完全电离.
解答:
解:(1)碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故答案为:NaHCO3═Na++HCO3-;
(2)硝酸钙电离时生成钙离子、硝酸根离子,其电离方程式为Mg(NO3)2═Mg2++2NO3-,故答案为:Mg(NO3)2═Mg2++2NO3-;
(3)一水合氨的电离方程式为:NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-.
(2)硝酸钙电离时生成钙离子、硝酸根离子,其电离方程式为Mg(NO3)2═Mg2++2NO3-,故答案为:Mg(NO3)2═Mg2++2NO3-;
(3)一水合氨的电离方程式为:NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-.
点评:本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,碳酸氢钠电离为该题易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
同温同压下,在等质量的二氧化硫气体和二氧化碳气体的比较中,正确的是( )
| A、密度比为11:16 |
| B、物质的量比为16:11 |
| C、体积比为11:16 |
| D、分子个数比为16:11 |
在下列条件下,一定能大量共存的离子组是( )
| A、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I- |
| B、强酸性溶液中:Al3+、K+、Mg2+、Cl-、SO42- |
| C、c(Fe3+)=0.1mol?L-1的溶液中:Na+、SCN-、Cl-、Br- |
| D、强碱性溶液中:ClO-、SO42-、SO32-、Na+ |
下列说法正确的是( )
| A、垃圾资源化的主要途径是卫生填埋 |
| B、浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 |
| C、硅是现代光学及光纤制品的基本原料 |
| D、铁粉可作抗氧化剂 |
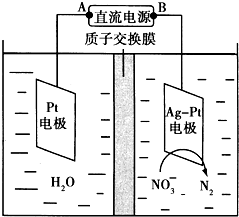 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染. 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.