题目内容
19.实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是A、C(填序号),配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒(填仪器名称).
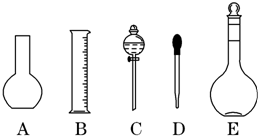
(2)下列操作中,容量瓶所不具备的功能有B、C、E(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为2.0 g.
配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:13.6 mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用15 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌.
分析 (1)根据配制一定物质的量浓度溶液用到仪器选择;
(2)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(3)依据m=CVM计算需要溶质氢氧化钠的质量;依据配置一定物质的量浓度溶液的步骤解答;
(4)根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的物质的量浓度,再根据配制过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积.依据浓硫酸体积选择合适的量筒;
浓硫酸密度大于水的密度,浓硫酸稀释过程中放出大量的热,应该将浓硫酸缓缓加入水中,顺序不能颠倒;
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管,不需要的仪器有烧杯和分液漏斗,还缺少的仪器为烧杯、玻璃棒,
故答案为:A、C; 烧杯、玻璃棒;
(2)量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选:B、C、E;
(3)需要0.1mol/L NaOH溶液450mL,则应选择500mL容量瓶,配制500mL溶液,需要溶质的质量m=0.5L×40g/mol×0.1mol/L=2.0g;
用浓溶液配制稀溶液时,配制的一般步骤为计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以正确的答案为:BCAFED;
故答案为:2.0 BCAFED;
(4)分数为98%、密度为1.84g•cm-3的浓硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制过程中硫酸的物质的量不变,设需要溶液体积为V,则V×18.4mol/L=0.5mol/L×0.5L,解得V=13.6mL,应选择15mL量筒;
稀释浓硫酸时应将浓硫酸沿器壁慢慢加入到水中,并不断搅拌,操作方法为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌,
故答案为:故答案为:13.6 15 向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌;
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算,清楚溶液配制的原理、明确配制过程和浓硫酸稀释的正确方法是解题关键,题目难度不大.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 23g Na在化学反应中失去的电子数目为NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 常温常压下,11.2 LSO3含有的氧原子数为1.5NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
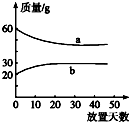 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )| A. | a升华、b冷凝 | B. | a冷凝、b吸水 | C. | a挥发、b潮解 | D. | a挥发、b吸水 |
| A. | 酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 | |
| B. | 只含有一种元素的物质都是纯净物 | |
| C. | 制糖工业中利用活性炭脱色制白糖的过程是物理变化 | |
| D. | 压强恒定时,气体在水中的溶解度随温度的升高而降低 |
| A. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| B. | 含大量Fe3+的溶液中:K+、I-、SO42-、NO3- | |
| C. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| D. | 由水电离出的c(H+)=1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42- |
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,2-二甲基-2-丁醇 | D. | 2,3-二甲基-1-丁醇 |