题目内容
14.常温下,下列各组离子在指定的溶液中可能大量共存的是( )| A. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| B. | 含大量Fe3+的溶液中:K+、I-、SO42-、NO3- | |
| C. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| D. | 由水电离出的c(H+)=1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42- |
分析 A.离子之间发生互促水解反应;
B.与Fe3+反应的离子不能大量共存;
C.通入足量CO2后的溶液呈酸性;
D.由水电离出的c(H+)=1.0×10-14mol/L的溶液可能呈酸性或碱性.
解答 A.Al3+、HCO3-离子之间发生互促水解反应,不能大量共存,故A错误;
B.I-与Fe3+发生氧化还原反应而不能大量共存,故B错误;
C.通入足量CO2后的溶液呈酸性,SiO32-不能大量共存,故C错误;
D.由水电离出的c(H+)=1.0×10-14mol/L的溶液可能呈酸性或碱性,酸性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存问题,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,题目难度中等,本题注意把握相关题给信息,为解答该类题目的关键,学习中注重相关基础知识的积累.

练习册系列答案
相关题目
5.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 标况下,22.4L单质溴所含有的原子数目为2NA | |
| C. | 2L 0.5 mol/L硫酸溶液中含有氢原子数目为2NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA |
2.对如图两种化合物的结构或性质描述错误的是( )
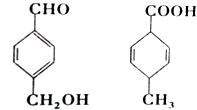

| A. | 互为同分异构体 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 均可以发生加成和取代反应 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
6.用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9].t1时刻a电极得到混合气体,其中Cl2在标准状况下为 224mL(忽略气体的溶解);t2时刻Cu全部在电极上析出.下列判断正确的是( )
| A. | a电极与电源的负极相连 | |
| B. | t2时,两电极的质量相差3.84 g | |
| C. | 电解过程中,溶液的pH不断增大 | |
| D. | t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
3.下列化学方程式中能用H++OH-═H2O表示的是( )
| A. | NH3•H2O+HCl═NH4Cl+H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Al(OH)3+3HCl═AlCl3+3H2O | D. | KOH+HNO3═KNO3+H2O |
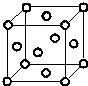 Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.
Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.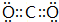 ,分子的空间构型是直线形;Z3+的原子结构示意图为
,分子的空间构型是直线形;Z3+的原子结构示意图为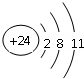 ;X2Q4分子中X原子的杂化方式为sp3杂化.
;X2Q4分子中X原子的杂化方式为sp3杂化.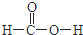 ,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g
,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g
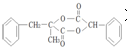 )是一种新型香料的主要成分之一.I的合成路线如下(部分产物和部分反应条件略去):
)是一种新型香料的主要成分之一.I的合成路线如下(部分产物和部分反应条件略去):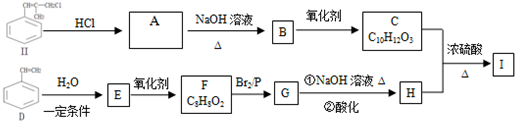

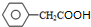 .
. .
. (写结构简式).
(写结构简式).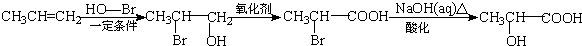 .
.