题目内容
9.已知某反应是放热反应,下列说法正确的是( )| A. | 该反应中反应物的总能量大于生成物的总能量 | |
| B. | 该反应中反应物的总能量小于生成物的总能量 | |
| C. | 该反应发生时,一定不需要加热 | |
| D. | 如果该反应开始后停止加热,反应一定能继续进行 |
分析 A.当反应物的总能量大于生成物的总能量时,反应是放热反应;
B.当反应物的总能量小于生成物的总能量时,反应是吸热反应;
C.有的放热反应需要在加热的条件下才能发生;
D.放热反应加热到一定温度引发后,放出的热不仅满足反应所需温度,多余的热将放出.
解答 解:A.反应物的总能量大于生成物的总能量时,该反应为放热反应,故A正确;
B.当反应物的总能量小于生成物的总能量时,反应是吸热反应,故B错误;
C.有的放热反应需要在加热的条件下才能发生,如铝热反应是放热反应,需要在加热的条件下进行,故C错误;
D.放热反应加热到一定温度开始引发,然后停止加热,反应放出的热已满足反应所需温度,反应一定能继续进行,故D正确;
故选AD.
点评 本题考查了化学反应的条件与化学反应的热效应间的关系,题目难度不大,需正确理解放热、吸热的本质是解题的关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
19.下列固体物质溶液水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化铝 ③硫酸铝 ④纯碱 ⑤氯化铜.
①胆矾 ②氯化铝 ③硫酸铝 ④纯碱 ⑤氯化铜.
| A. | ③④ | B. | ①③④ | C. | ①②③④ | D. | 全部 |
4.“类推”常用的学习方法,但有时会产生错误结论.下列类推的结论中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 常见的氢化物是分子晶体,则所有氧化物都是分子晶体 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
14.下列关于铝及其化合物的叙述正确的是( )
| A. | 氢氧化铝可作胃酸的中和剂 | B. | 工业上采用电解熔融氯化铝制铝 | ||
| C. | 铝罐可久盛食醋 | D. | 明矾用作净水剂不涉及化学变化 |
18.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,4.48L Cl2溶于水所得氯水中含氯的微粒总数为0.4NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
11.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示:
由上述现象可推知c为:BaCl2(写化学式,后同),d为:Na2CO3,a与b反应的离子方程式为Ag++Cl-=AgCl↓.
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
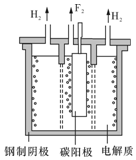 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.