题目内容
1.为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如图: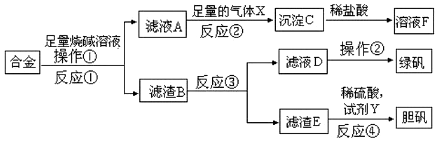
回答下列问题:
(1)操作①的名称为过滤,沉淀C的化学式为Al(OH)3.
(2)在滤渣B中滴加稀硫酸时,发现反应速率比同浓度硫酸与纯铁粉反应要快,原因是形成铁铜原电池,加快了反应速率.
(3)在滤渣B中滴加的硫酸可用SO2制取,可按以下三步进行:
已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197KJ/mol
H2O(g)═H2O(l)△H2=-44KJ/mol
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545KJ/mol
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
(4)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色最后变成红褐色,证明D中有Fe2+或取少量滤液D加入硫氰化钾溶液,无现象,再加入氯水,显血红色,则证明D中有Fe2+.
(5)常温下,乙同学将绿矾配成约0.1mol•L-1FeSO4溶液,测得溶液的pH=3,请用离子方程式解释其原因Fe2++2H2O?Fe(OH)2+2H+,该溶液中c(SO42-)-c(Fe2+)=5×10-4mol•L-1(填近似数值).
(6)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,则反应④的总反应化学方程式为Cu+H2O2+H2SO4+3H2O═CuSO4•5H2O或Cu+H2O2+H2SO4═CuSO4+2H2O.
分析 合金加入足量的烧碱溶液后,金属铝溶解,过滤得滤渣B为铁、铜,滤液A中含偏铝酸钠,通入足量的气体X为二氧化碳气体,得到沉淀C为氢氧化铝沉淀;氢氧化铝沉淀加盐酸溶解得到溶液F为氯化铝;滤渣B加入稀硫酸,铁与稀硫酸反应,过滤,得到滤液D为硫酸亚铁溶液,蒸发浓缩、降温结晶得到绿矾,滤渣E主要为铜,铜中加和稀硫酸再加氧化剂Y如双氧水等,得硫酸铜溶液,蒸发浓缩、降温结晶得到胆矾,据此分析.
(1)分离固体和液体的操作是过滤;金属铝可以和强碱发生反应生成偏铝酸盐和氢气;偏铝酸盐可以和二氧化碳气体反应生成氢氧化铝沉淀;
(2)形成原电池能加快反应速率,在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了原电池;
(3)利用盖斯定律,将热化学方程式进行运算,(③-①+②)×$\frac{1}{2}$计算反应的焓变,得到SO3 (g)与H2O(l)反应的热化学方程式.
(4)滤液D中含有的金属离子是亚铁离子,根据亚铁离子的检验方法来回答;
(5)FeSO4溶液中,亚铁离子水解使溶液呈酸性,根据电荷守恒可计算出c(SO42-)-c(Fe2+)的值;
(6)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应,铜和硝酸、硫酸反应生成硫酸铜,据此书写化学方程式.
解答 解:(1)依据题给信息得出操作①后得到的是滤液和滤渣,故此分离操作为过滤,具体过程为合金加入足量的烧碱溶液后,金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,金属铝溶解,过滤得滤渣B为铁、铜,滤液A中含偏铝酸钠,偏铝酸钠中通入二氧化碳,则可以和二氧化碳气体反应生成氢氧化铝沉淀,即2H2O+AlO2-+CO2═Al(OH)3↓+HCO3-,所以通入足量的气体X为二氧化碳气体,得到沉淀C为氢氧化铝沉淀,
故答案为:过滤;Al(OH)3;
(2)在滤渣B中有Cu和Fe,在溶液中形成原电池,铁做负极,铜做正极,形成原电池能加快反应速率,故在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,
故答案为:形成铜铁原电池,加快了反应速率;
(3)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①+②)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
(4)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,或用氯水先氧化,再用硫氰化钾溶液检验,故亚铁离子的检验方法:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,或取少量滤液D加入硫氰化钾溶液,无现象,再加入氯水,显血红色,则证明D中有Fe2+;
故答案为:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色最后变成红褐色,证明D中有Fe2+或取少量滤液D加入硫氰化钾溶液,无现象,再加入氯水,显血红色,则证明D中有Fe2+;
(5)FeSO4溶液中,亚铁离子水解使溶液呈酸性,反应的离子方程式为Fe2++2H2O?Fe(OH)2+2H+,根据电荷守恒有2c(SO42-)-2c(Fe2+)=c(H+)-c(OH-)=1×10-3,所以(SO42-)-c(Fe2+)=5×10-4,
故答案为:Fe2++2H2O?Fe(OH)2+2H+;5×10-4;
(6)稀硫酸不能将铜氧化,故在滤渣E中加入稀硫酸和H2O2制胆矾晶体,是H2O2将Cu氧化为Cu2+,H2O2被还原为H2O,稀硫酸只做酸,方程式为:Cu+H2O2+H2SO4+3H2O═CuSO4•5H2O或Cu+H2O2+H2SO4═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4+3H2O═CuSO4•5H2O或Cu+H2O2+H2SO4═CuSO4+2H2O.
点评 本题主要考查了怎样从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,试题培养了学生综合应用知识的能力,题目难度中等.

| A. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| B. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、海水晒盐、燃煤烟气的脱硫、从菜籽中提取菜籽油等过程都是物理变化 |
| A. | 该反应中反应物的总能量大于生成物的总能量 | |
| B. | 该反应中反应物的总能量小于生成物的总能量 | |
| C. | 该反应发生时,一定不需要加热 | |
| D. | 如果该反应开始后停止加热,反应一定能继续进行 |

已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+.(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为3.2≤X<4.0.
(4)书写出由沉淀C制备铝的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
| A. | 蓝色硫酸铜 | B. | 液体浓硫酸 | C. | 无水氯化钙 | D. | 白色碱石灰 |
| A. | 能与水互溶 | B. | 能与NaHCO3反应 | ||
| C. | 能发生酯化反应 | D. | 能与甲烷发生反应 |
 ,构成E单质的元素在周期表中位于第四周期第Ⅷ族.
,构成E单质的元素在周期表中位于第四周期第Ⅷ族. .
.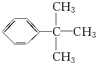 .
.