题目内容
11.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示:| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
分析 b+d反应生成无色气体,则b、d为HCl、Na2CO3中的一种,而d+c、d+a均生成白色沉淀,则d为Na2CO3,所以b为HCl,a+b反应生成白色沉淀,a为AgNO3,可知c为BaCl2,以此来解答.
解答 解:由表中反应物及现象可知,b+a反应生成无色气体,则b、d为HCl、Na2CO3中的一种,
又d+c、d+a均生成白色沉淀,则d为Na2CO3,所以b为HCl,
a+b反应生成白色沉淀,a为AgNO3,可知c为BaCl2,
a与b反应的离子方程式为,
故答案为:BaCl2;Na2CO3;Ag++Cl-=AgCl↓.
点评 本题考查物质的推断,为高频考点,侧重考查学生的分析能力,明确物质的性质及发生的反应中的现象是解答本题的关键,注意把握物质的性质,b与d反应及d的推断是解答本题的突破口,题目难度不大.

练习册系列答案
相关题目
9.已知某反应是放热反应,下列说法正确的是( )
| A. | 该反应中反应物的总能量大于生成物的总能量 | |
| B. | 该反应中反应物的总能量小于生成物的总能量 | |
| C. | 该反应发生时,一定不需要加热 | |
| D. | 如果该反应开始后停止加热,反应一定能继续进行 |
16.构成金属晶体的基本微粒是( )
| A. | 分子 | B. | 原子 | ||
| C. | 阳离子与阴离子 | D. | 阳离子与自由电子 |
1.NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
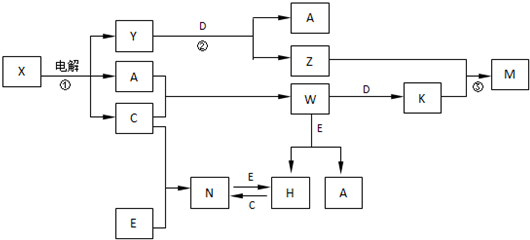
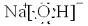 ,构成E单质的元素在周期表中位于第四周期第Ⅷ族.
,构成E单质的元素在周期表中位于第四周期第Ⅷ族. .
.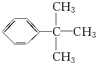 .
.