题目内容
14.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
分析 平衡常数K是温度的函数,只与温度有关,温度一定,平衡常数K值一定,温度发生变化,平衡常数K值也发生变化.
解答 解:影响化学平衡的因素主要有浓度、温度、压强等.
A.K值只与温度有关,若在其他条件不变时,增大反应物的浓度或减小生成物的浓度,有利于正反应的进行,K值不变,平衡向右移动,故A正确;
B.若是改变浓度或压强使平衡发生移动,而温度不变,则K值不变,故B错误;
C.若在其他条件不变时,增大反应物的浓度或减小生成物的浓度,有利于正反应的进行,平衡向右移动,但K值只与温度有关,故K值不变,故C正确;
D.K值是温度的函数,K值变化,说明温度发生了改变,则平衡一定发生移动,故D正确;
故选B.
点评 本题考查平衡常数与平衡移动的关系,题目难度中等.要注意平衡常数K是温度的函数,只与温度有关.

练习册系列答案
相关题目
7.常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )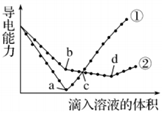

| A. | b点,水电离产生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的变化曲线 | ||
| C. | a、d两点对应的溶液均显中性 | D. | c点,两溶液中含有相同量的 OH- |
7.下列化学用语表示正确的是( )
| A. | 次氯酸钙的化学式:CaClO2 | |
| B. | 作为相对原子质量标准的碳原子可表示为:126C | |
| C. | 钠原子的结构示意图: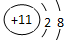 | |
| D. | 硫酸的电离方程式:H2SO4═H++SO42- |
 ·H2O)=c(Cl—)
·H2O)=c(Cl—)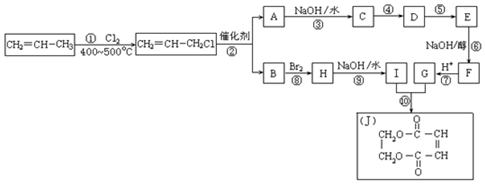
 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯. .
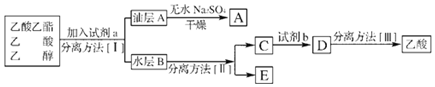
. 实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)
实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)