题目内容
14.下列是有关钠及其化合物性质的描述不正确的是( )| A. | 在水中的溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 相同条件下与同浓度的盐酸反应产生气体的速率:Na2CO3>NaHCO3 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应生成的CO2的量:Na2CO3=NaHCO3. |
分析 A.相同条件下,碳酸铵的溶解度大于碳酸氢钠的溶解度;
B.碳酸氢钠受热分解,而碳酸钠受热不分解;
C.碳酸氢钠和盐酸的反应速率快于碳酸钠和盐酸的反应速率;
D.等物质的量的Na2CO3、NaHCO3与足量的盐酸反应时,含碳相同,结合碳元素守恒来计算.
解答 解:A.向饱和碳酸钠溶液中通入二氧化碳析出碳酸氢钠晶体,则相同条件下,在水中的溶解性为NaHCO3<Na2CO3,故A正确;
B.碳酸氢钠受热分解,而碳酸钠受热不分解,则热稳定性为NaHCO3<Na2CO3,故B正确;
C.碳酸氢钠和盐酸一步反应,而碳酸钠和盐酸反应分步完成,所以与盐酸反应的速率为NaHCO3>Na2CO3,故C错误;
D.等物质的量的Na2CO3、NaHCO3与足量的盐酸反应时,含碳相同,由碳元素守恒可知生成二氧化碳相同,故D正确;
故选C.
点评 本题考查碳酸钠和碳酸氢钠性质的比较,为高频考点,把握二者性质的差异是解答的关键,注意知识的积累和灵活应用,题目难度不大.

| A. | 溶液和胶体的本质区别是能否产生丁达尔现象 | |
| B. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| C. | 江河入海口处易形成三角洲,这与胶体的性质有关 | |
| D. | 胶体的分散质不能通过滤纸 |
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n>p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n<p+q |
| A. | 氨气 | B. | 二氯甲烷 | C. | 四氯甲烷 | D. | 白磷 |
| A. | 4:3 | B. | 7:3 | C. | 2:3 | D. | 3:2 |
| A. | 加入适量等浓度的NaOH溶液 | B. | 加入适量水 | ||
| C. | 通入适量H2S气体 | D. | 加入适量等浓度的NaHS溶液. |
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法I | 用碳粉在高温条件下还原CuO |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
方法III | 电解法,反应为2Cu+H2O |
(1)已知:2Cu(s)+ O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
C(s)+ O2(g)=CO(g)△H=﹣bkJ•mol﹣1
O2(g)=CO(g)△H=﹣bkJ•mol﹣1
Cu(s)+ O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJ•mol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
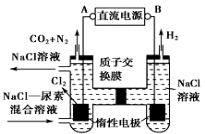
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .

(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5mol•L﹣1•min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 Cu2O+H2↑
Cu2O+H2↑