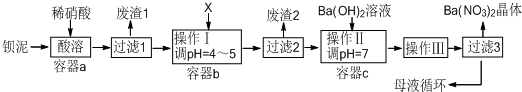
题目内容
4.下列说法正确的是( )| A. | 溶液和胶体的本质区别是能否产生丁达尔现象 | |
| B. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| C. | 江河入海口处易形成三角洲,这与胶体的性质有关 | |
| D. | 胶体的分散质不能通过滤纸 |
分析 A.胶体的分散质微粒直径大小是胶体区别于其它分散系的本质特征所在;
B.溶液和胶体呈电中性;
C.江河中的泥沙属于胶体分散系;
D.胶体能透过滤纸.
解答 解:A.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,不是有丁达尔效应,故A错误;
B.溶液和胶体呈电中性,胶粒因吸附带电荷,故B错误;
C.江河中的泥沙属于胶体分散系,江河入海口三角洲的形成与胶体的聚沉性质有关,故C正确;
D.胶粒能透过滤纸,故D错误.
故选C.
点评 本题考查胶体的性质,注意胶体分散质微粒直径、胶体具有丁达尔效应、电泳等性质,题目较简单.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
15.某离子反应中涉及H2O、ClO?、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )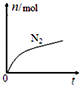

| A. | 该反应的还原剂是Cl- | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
12.(1)不同温度下水的离子积常数如表所示:
请用文字解释随温度升高水的离子积增大的原因:水电离吸热,升高温度后平衡正向移动;
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
向NaCN溶液中通入少量CO2,所发生反应的化学方程式为CO2+H2O+NaCN═NaHCO3+HCN.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
9.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
13.下列说法中正确的是( )
| A. | 制作航天服的聚脂纤维是新型无机非金属材料 | |
| B. | 肥皂可以用来去油污 | |
| C. | 金属的腐蚀属于物理变化 | |
| D. | 煤的气化属于化学变化 |
14.下列是有关钠及其化合物性质的描述不正确的是( )
| A. | 在水中的溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 相同条件下与同浓度的盐酸反应产生气体的速率:Na2CO3>NaHCO3 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应生成的CO2的量:Na2CO3=NaHCO3. |