题目内容
2.下列分子中,含有极性共价键且呈正四面体结构的是( )| A. | 氨气 | B. | 二氯甲烷 | C. | 四氯甲烷 | D. | 白磷 |
分析 A.氨气分子中含有极性共价键N-H,空间构型为三角锥形;
B.二氯甲烷分子中含有极性共价键N-H、N-Cl,空间构型为四面体结构;
C.四氯甲烷分子中含有极性共价键C-Cl,空间构型为正四面体结构;
D.白磷分子中含有非极性共价键P-P,空间构型为正四面体结构.
解答 解:A.氨气分子含有极性共价键N-H,空间构型为三角锥形,故A错误;
B.二氯甲烷分子中含有极性共价键N-H、N-Cl,两种键键长不同,空间构型为四面体结构,故B错误;
C.四氯甲烷分子中含有极性共价键C-Cl,空间构型为正四面体结构,故C正确;
D.白磷分子中含有非极性共价键P-P,空间构型为正四面体结构,故D错误;
故选C.
点评 本题考查了常见有机物的分子结构,题目难度不大,注意把握极性键和非极性键的区别,加强常见有机物分子空间构型的识记.

练习册系列答案
相关题目
12.(1)不同温度下水的离子积常数如表所示:
请用文字解释随温度升高水的离子积增大的原因:水电离吸热,升高温度后平衡正向移动;
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
向NaCN溶液中通入少量CO2,所发生反应的化学方程式为CO2+H2O+NaCN═NaHCO3+HCN.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
13.下列说法中正确的是( )
| A. | 制作航天服的聚脂纤维是新型无机非金属材料 | |
| B. | 肥皂可以用来去油污 | |
| C. | 金属的腐蚀属于物理变化 | |
| D. | 煤的气化属于化学变化 |
10.某些含羟基的药物具有苦味,如氯霉素(结构见图) 分子式为C11H12O5N2Cl2.此药物分子中碳链末端羟基中的氢原子换成来自棕榈酸中的原子团 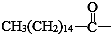 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )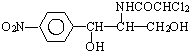
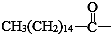 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )
| A. | 无味氯霉素的分子式为:C27H44O6N2Cl2 | |
| B. | 它的水溶性变差,所以苦味消失 | |
| C. | 它是棕榈酸的盐类 | |
| D. | 它的水溶性变良,所以苦味消失 |
17.SF6分子结构中只存在S-F键,是一种优良的绝缘气体,制备原理:S(s)+3F2(g)→SF6(g)+Q.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则反应热效应Q的值为(单位:kJ)( )
| A. | 1780 | B. | 1220 | C. | -1220 | D. | -1780 |
14.下列是有关钠及其化合物性质的描述不正确的是( )
| A. | 在水中的溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 相同条件下与同浓度的盐酸反应产生气体的速率:Na2CO3>NaHCO3 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应生成的CO2的量:Na2CO3=NaHCO3. |
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射 | 有丁达尔效应 | 微蓝色液体为胶体 |
B | 将FeSO4高温强热,得红棕色固体,产生的气体通入BaCl2溶液 | 产生白色沉淀 | 白色沉淀为BaSO4和BaSO3 |
C | 将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀生成 | Y中一定含有SO42- |