题目内容
19.将盛满NO、O2的混合气体的试管倒立于水中,让其充分反应,结果剩余$\frac{3}{10}$体积气体,原混合气体中NO和O2的体积比可能是( )| A. | 4:3 | B. | 7:3 | C. | 2:3 | D. | 3:2 |
分析 发生反应为4NO+3O2+2H2O=4HNO3,剩余的$\frac{3}{10}$体积气体可能为NO,也可能为O2,当剩余的$\frac{3}{10}$体积为NO时,根据反应4NO+3O2+2H2O=4HNO3计算出氧气的体积,从而可知NO的体积;
当剩余的$\frac{3}{10}$体积为O2时,结合反应4NO+3O2+2H2O=4HNO3计算出NO的体积,再计算出氧气的体积,最后计算出原混合气体中NO和O2的体积比.
解答 解:将盛满NO、O2的混合气体的试管倒立于水中,发生反应的方程式为:4NO+3O2+2H2O=4HNO3,
剩余的$\frac{3}{10}$体积气体可能为NO,也可能为O2,
当剩余的$\frac{3}{10}$体积为NO时,参加反应4NO+3O2+2H2O=4HNO3的气体体积为$\frac{7}{10}$体积,则原混合气体中含有氧气体积为:$\frac{7}{10}$体积×$\frac{3}{7}$=$\frac{3}{10}$体积,原混合气体中含有NO体积为$\frac{7}{10}$体积,原混合气体中NO和O2的体积比为:$\frac{7}{10}$体积:$\frac{3}{10}$体积=7:3;
当剩余的$\frac{3}{10}$体积为O2时,参加反应4NO+3O2+2H2O=4HNO3的气体体积为$\frac{7}{10}$体积,则原混合气体中含有NO体积为:$\frac{7}{10}$体积×$\frac{4}{7}$=$\frac{2}{5}$体积,原混合气体中含有O2体积为$\frac{3}{5}$体积,原混合气体中NO和O2的体积比为:$\frac{2}{5}$体积:$\frac{3}{5}$体积=2:3;
根据分析可知,原混合气体中NO和O2的体积比可能是7:3或2:3,
故选BC.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的化学计算能力.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
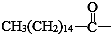 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )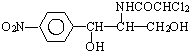
| A. | 无味氯霉素的分子式为:C27H44O6N2Cl2 | |
| B. | 它的水溶性变差,所以苦味消失 | |
| C. | 它是棕榈酸的盐类 | |
| D. | 它的水溶性变良,所以苦味消失 |
| A. | 在水中的溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 相同条件下与同浓度的盐酸反应产生气体的速率:Na2CO3>NaHCO3 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应生成的CO2的量:Na2CO3=NaHCO3. |
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |
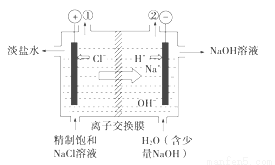
 ﹣+2H+
﹣+2H+ Cl2↑+H2↑
Cl2↑+H2↑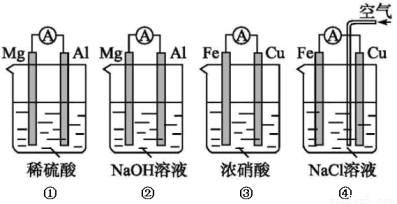
 -=H2↑
-=H2↑