题目内容
20.下列对能量转化的认识中,不正确的是( )| A. | 电解水生成氢气和氧气时,其能量转化主要是电能转化为化学能 | |
| B. | 某反应的反应物总能量低于生成物总能量,其能量转化主要是热能转化为化学能 | |
| C. | 大多数置换反应发生时,其能量转化主要是化学能转化为热能 | |
| D. | 铅蓄电池放电时,其能量转化主要是电能转化为化学能 |
分析 A、电解水是电能转化为化学能;
C、反应物总能量低于生成物总能量,则反应是吸热反应,据此回答;
C、置换反应的能量转化主要是化学能和热能之间的转化;
D、铅蓄电池放电时,属于原电池的工作原理,是化学能转化为电能的过程.
解答 解:A、电解水生成氢气和氧气的电解装置是将电能转化为化学能的装置,故A正确;
B、反应物总能量低于生成物总能量,则反应是吸热反应,伴随热能和化学能化学能之间的转化,故B正确;
C、大多数置换反应属于放热的,反应发生时,其能量转化主要是化学能转化为热能,故C正确;
D、铅蓄电池放电时,属于原电池的工作原理,是化学能转化为电能的过程,不是电能转化为化学能,故D错误.
故选D.
点评 本题考查了化学反应能量变化的实质分析,主要是能量变化形式、能量变化的判断依据,掌握基础是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列各组元素中,属于同一主族的是( )
| A. | F、Cl、Br | B. | Na、Mg、Al | C. | Si、P、S | D. | O、S、Cl |
5.下列的结构简式正确的是( )
| A. | CH3COH | B. | CH3CH2OH | C. | HO-CH3CH3-OH | D. | CH2CH2 |
12.某盐酸试剂瓶上的标签如图.下列有关说法正确的为( )


| A. | 该浓度的盐酸可以用广口瓶盛装 | |
| B. | 该试剂的物质的量浓度为11.9mol/L | |
| C. | 用该盐酸配制250毫升2.0摩尔、升的稀盐酸时需要选用100毫升量筒 | |
| D. | 该盐酸中所含Cl-数目为5.95NA |
9.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁 H++AlO2-+H2O.
H++AlO2-+H2O. .
. .
. A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应. 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: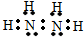 .
.