题目内容
7.下列离子方程式书写正确的是( )| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
分析 A.氢氧化钠过量反应生成碳酸钙、碳酸钠和水;
B.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子;
C.二氧化硫少量,反应生成亚硫酸钠和水;
D.电荷不守恒.
解答 解:A.向饱和碳酸氢钙溶液中加入过量的NaOH溶液,离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故A错误;
B.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.氢氧化钠溶液吸收少量SO2气体,离子方程式:SO2+2OH-=SO32-+H2O,故C正确;
D.硫酸亚铁加过氧化氢溶液,离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,故D错误;
故选D.
点评 本题考查了离子方程式的判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等是解题关键,注意离子方程式遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
18.95℃时某溶液的pH=6,对该溶液的判断正确的是( )
| A. | 呈酸性 | B. | c(H+)=1×10-6mol/L | ||
| C. | c(OH-)=1×10-6mol/L | D. | 无法判断 |
15.下列各组元素中,属于同一主族的是( )
| A. | F、Cl、Br | B. | Na、Mg、Al | C. | Si、P、S | D. | O、S、Cl |
2.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )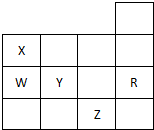

| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
12.某盐酸试剂瓶上的标签如图.下列有关说法正确的为( )


| A. | 该浓度的盐酸可以用广口瓶盛装 | |
| B. | 该试剂的物质的量浓度为11.9mol/L | |
| C. | 用该盐酸配制250毫升2.0摩尔、升的稀盐酸时需要选用100毫升量筒 | |
| D. | 该盐酸中所含Cl-数目为5.95NA |
19.下列关于物质的分类、性质、用途说法全部正确的是( )
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
16.0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是( )
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |